Negli ultimi due anni la comunità dei pazienti e dei familiari è bombardata da molteplici messaggi su genomica, biomarcatori, medicina di precisione, … . I mezzi di comunicazione non aiutano molto perché pur di colpire l’attenzione dei lettori utilizzano titoli che lasciano presagire che la cura dei tumori sia dietro l’angolo. Non è vero in generale ma soprattutto non è vero ad oggi per il tumore al pancreas, per il quale le uniche indicazioni per la profilazione molecolare riguardano la valutazione dell’instabilità dei microsatelliti, dovuta ad un deficit nel sistema di riparazione del DNA, 1-3% dei pazienti, e le mutazioni dei geni BRCA, 5-10% dei pazienti. Mentre la prima indicazione apre le porte all’utilizzo dell’immunoterapia, la seconda permette di inserire i pazienti in programmi di screening ad hoc. Pazienti e familiari naturalmente continuano ad interrogarsi sull’appropriatezza della cure chemioterapiche proposte e si domandano se esistano degli strumenti per meglio calibrare i pochi protoccoli a disposizione, aumentati certamente negli ultimi dieci anni ma non ancora sufficienti. Daniele Maiolo, ricercatore nel settore delle nanotecnologie al Politecnico di Milano, in questo articolo ci descrive un caso reale e, come tiene a precisare, un caso non fa statistica.
Il Problema

Il medico come un sarto. Illustrazione di Catherine Lazure
Il tumore al pancreas è uno dei big killer, uno dei tumori più aggressivi e mortali. Basti pensare che negli USA nel 2017 ha superato per morti il tumore al seno, uno dei tumori più diffusi. Lo sanno molto bene i pazienti ed i loro familiari, che si trovano a fare i conti con questa patologia così severa e per cui non esistono biomarcatori predittivi che possano guidare a priori la scelta della terapia. I pazientei auspicano e sperano di poter fare un’analisi specifica che possibilmente caratterizzi la biologia del proprio tumore e a quali farmaci è sensibile. Molta ricerca si sta facendo in tal senso per riuscire ad ottenere il profilo molecolare del tumore ma i risultati importanti non sono ancora arrivati.
Cos’è la Profilazione Molecolare e su che tessuto viene effettuata
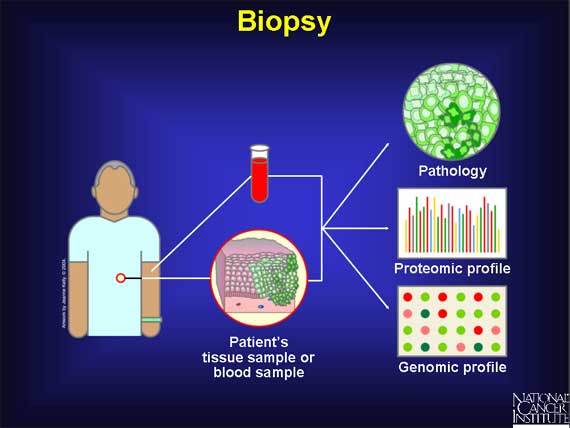
La profilazione molecolare è un’analisi che permette di creare la carta d’identità del tumore: ci dice come il tumore è fatto dal punto di vista molecolare, ossia quali sono i geni, i frammenti di DNA e le proteine che guidano e orchestrano la crescita tumorale e di conseguenza da quali terapie potremmo trarre vantaggio. Potenzialmente conoscendo il profilo molecolare del tumore di un paziente si potrebbe sviluppare, il condizionale è d’obbligo, una terapia specifica ed adatta allo specifico caso, o quantomeno utilizzare una terapia verosimilmente più appropriata tra quelle esistenti. Ad oggi non avendo una qualche indicazione su come poter associare una cura ad una tipologia tipologia di tumore l’oncologo sceglie la terapia sulla base dello stato di salute del paziente, dei precedenti trattamenti somministrati e della propria esperienza.
Per eseguire una profilazione servono le cellule tumorali o il materiale da queste rilasciato. Le cellule possono essere ottenute partendo da tessuto proveniente dal tumore espiantato, da biopsie tumorali derivanti dal tumore primario o da metastasi e da ciò che viene chiamata biopsia liquida. Quest’ultima permetterebbe, facendo un semplice prelievo del sangue e con le opportune tecniche diagnostiche, di ottenere informazioni riguardanti il profilo molecolare del tumore originale evitando indagini invasive come le biopsie. Il limite delle biopsie liquide è legato alla diluizione del materiale rilasciato dal tumore nei fluidi, attività questa paragonabile alla ricerca di un ago in un pagliaio. Al momento esistono solo sperimentazioni nel campo delle biopsie liquide per il pancreas, niente a livello di pratica clinica.
Il Contesto Scientifico
Recentemente si è visto un proliferare di test poco specifici per il tumore al pancreas che promettono di dare un aiuto nella scelta terapeutica ma cui è bene dare una valutazione molto attenta facendosi consigliare dal proprio oncologo di fiducia. Ad Agosto 2017 alcuni test genetici della Foundation-One sono stati approvati dalla FDA, l’agenzia americana preposta all’autorizzazione di nuovi farmaci negli USA, per alcune forme tumorali, il tumore del pancreas non è tra questi. Questi test si preoccupano fondamentalmente di evidenziare la presenza di mutazioni nel DNA. Altri test, ad esempio quello promosso dall’associazione PANCAN nell’ambito del trial Know Your Tumor®, hanno un approccio più olistico e oltre a valutare le mutazioni al DNA cercano di capire se ci sono marcatori proteici che possono indirizzare la scelta della terapia, come ad esempio nel caso dell’immunoterapia che si è visto funzionare meglio in pazienti in cui le proteine implicate nella riparazione del DNA sono mutate o non presenti.
Ma qual è la reale utilità di questi test?
Innanzitutto è bene ricordare che sono state condotte poche sperimentazioni cliniche specifiche per il tumore al pancreas in questo contesto, un esempio ne è lo studio recentemente pubblicato e visionabile all’indirizzo: http://jgo.amegroups.com/article/view/16797/13875. Quindi se si decide di optare per l’esecuzione di uno di questi test bisogna essere consapevoli che sono sperimentali e non clinicamente approvati. Questo ha delle implicazioni pratiche, ossia anche dopo aver fatto il test ed aver determinato la presenza di mutazioni o altri biomarcatori, l’oncologo difficilmente nel caso del tumore del pancreas potrà prescrivere un farmaco che operi come una terapia mirata per lo specifico caso. I risultati sperimentali e clinici nel campo del tumore al pancreas per quanto concerne le terapie mirata o di precisione non sono molto confortanti ad oggi. Per esempio uno studio condotto dal Memorial Sloan Kettering Cancer Center ha evidenziato come solo l’uno per cento di pazienti beneficia di approcci di medicina personalizzata appunto perché non esistono indicazioni e farmaci approvati dagli organismi di controllo come la FDA americana e l’AIFA italiana. In più bisogna ricordare che per i geni che più ricorrentemente mutati nel tumore al pancreas, RAS e P53, non esistono farmaci specifici, precludendo ciò la possibilità di terapie mirate. La comunità medica scientifica non ha ancora raggiunto un consenso sull’utilità o meno di questi test per il tumore del pancreas anche se sul mercato cominciano ad apparire aziende che promettono cure specifiche per il tumore del pancreas su base genetica. Ma è importante per i pazienti sapere che si sta lavorando a livello di ricerca di base e di sperimentazioni cliniche per capire chi possa beneficiare di questi approcci. Basti pensare alla recente pubblicazione dell’atlante delle mutazioni dei tumori, al lavoro del PANCAN Tumor Atlas e al mega studio clinico condotto dall’istituto tumori americano NCI-match. Tutto questo apre una ragionevole speranza che nel giro di qualche anno cominceremo ad avere più informazioni in tale senso e probabilmente, quello che ad oggi è un sogno, una terapia mirata su misura del paziente, possa avvicinarsi in qualche forma alla realtà come è successo per altre forme tumorali.
Un Caso Reale
Sperando possa essere d’aiuto racconterò l’esperienza che ha avuto mio padre:
Luglio del 2016 a 59 anni viene diagnosticato un tumore alla testa del pancreas resecabile. Il tumore viene rimosso e l’istologia conferma un adenocarcinoma duttale con presenza microscopica di cellule di adenocarcinoma su un margine tumorale.
Nel Settembre 2016 il paziente comincia la terapia adiuvante in prima istanza con Gemcitabina per tre mesi. La prima ristadiazione al termine della chemio adiuvante dimostrava l’assenza di malattia.
A Gennaio 2017 per 40 giorni viene eseguito un ciclo di chemio-radio concomitante a base di capecitabina e radioterapia seguito da ulteriori due cicli di chemio.
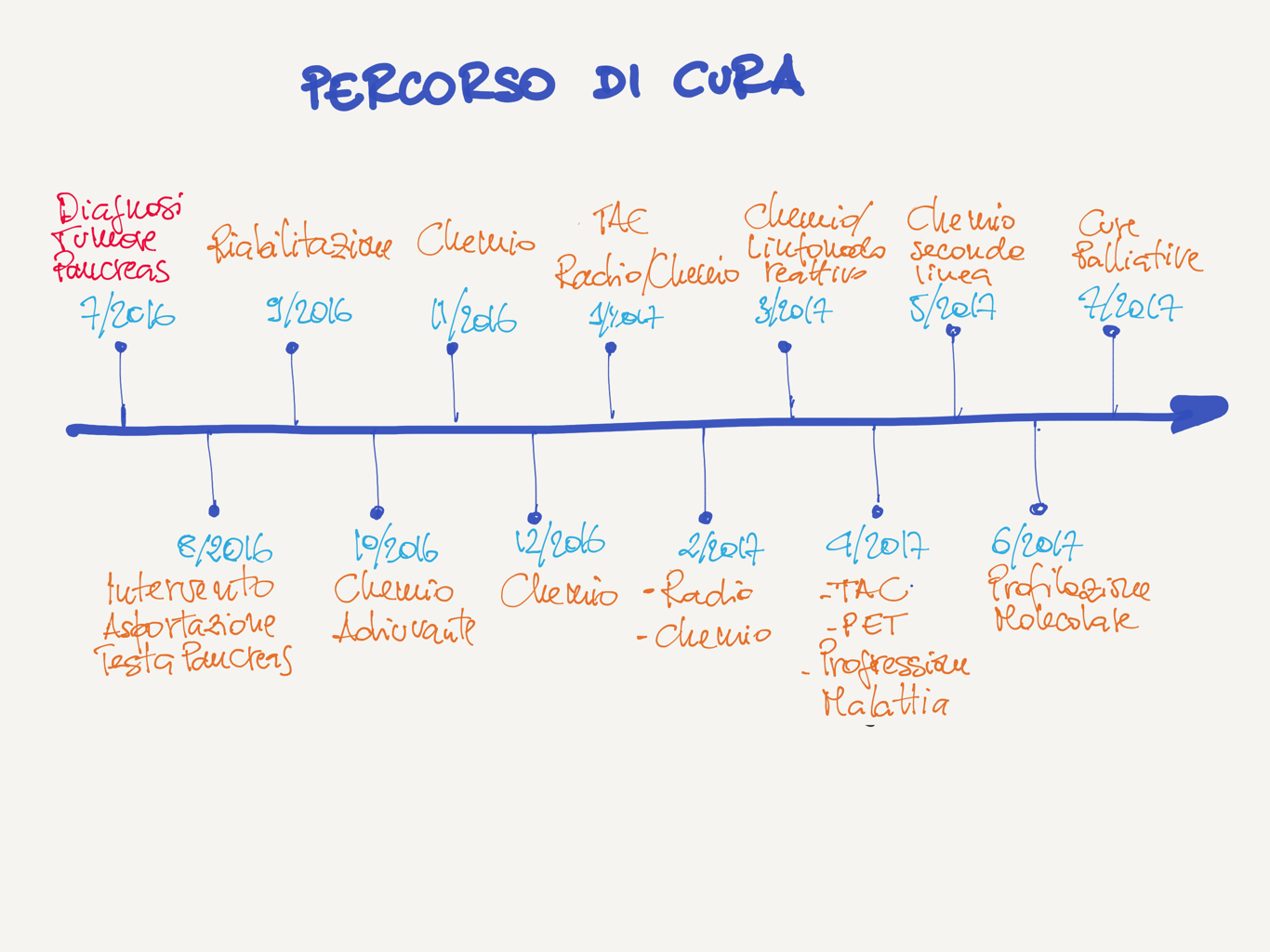
Ad Aprile 2017 viene eseguita una ristadiazione al termine della chemio che riporta la comparsa di metastasi peritoneali.
A Maggio 2017 l’oncologo decide così di cominciare la una terapia di seconda linea a base di 5-FU e oxaliplatino (FOLFOX).
A questo punto per individuare strade alternative in caso di fallimento della terapia di seconda linea che potessero portare all’inclusione in qualche trial clinico ci siamo rivolti ad un laboratorio privato per effettuare una profilazione molecolare del tumore. Un frammento dell’espianto tumorale ottenuto in occasione dell’intervento chirurgico viene quindi spedito per effettuare delle analisi in cieco, ossia il laboratorio non sa di precedenti terapie e l’iter terapeutico del paziente. Nel frattempo il paziente ha una severa soppressione immunitaria accompagnata da una colangite che provoca una sepsi.
Il paziente riesce quindi a terminare un solo ciclo di chemio di seconda linea. La malattia progredisce portando all’ostruzione del duodeno e dello stomaco provocando il decesso del paziente nel Luglio 2017.
Pochi giorni dopo il decesso arrivano gli esiti della profilazione molecolare, che portano ad una indicazione della funzionalità o meno di alcuni farmaci, vediamola in dettaglio.
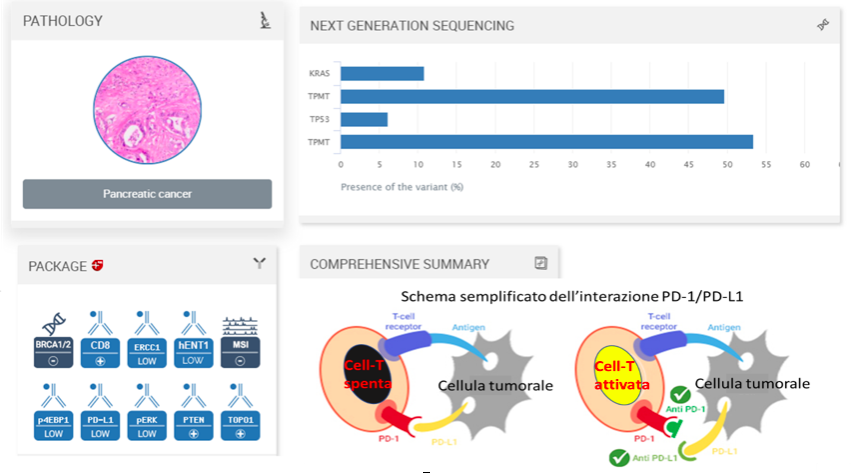
Figura 1 Prospetto riassuntivo della profilazione molecolare ed istologica del tumore (adattato da ONCODNA):
Nel Riquadro Pathology in alto a sinistra viene riporta l’analisi istologica che conferma il tumore pancreatico,
Nel Riquadro Next Generation Sequencing a destra viene descritto il profilo di mutazione genetiche presenti nel tumore.
Nel Riquadro Package In basso a sinistra la profilazione proteomica di alcuni marcatori di efficacia di terapia valutati,
Nel Riquadro Comprehensive Summary al centro viene riportato un riassunto del meccanismo di azione dei farmaci immunoterapici diretti contro la proteina PD-1 e PD-L1. In particolare i tumori che esprimono alti livelli del PD-L1 riescono a bloccare la funzione delle cellule immunitarie T interagendo con la proteina PD-1 che invia segnali alla cellula che vengono tradotti in un blocco della risposta immunitaria verso il tumore. I farmaci immunoterapici vanno a bloccare questa interazione ripristinando la risposta immunitaria verso il tumore che venendo riconosciuto come corpo estraneo viene attaccato dalle cellule T. Il paziente in questione ha un profilo PD-L1 low, MSI -, CD8+ (vedi Package) che vuol dire rispettivamente bassi livelli della proteina PD-L1, negativo per instabilità di microsatelliti un marker che può indicare la potenziale funzionalità dell’immunoterapia, e alti livelli di cellule T . Questo profilo con due fattori negativi (PD-L1 low e MSI -) ed uno positivo (CD-8 +) rende non valutabile la possibile funzionalità dell’immunoterapia in quanto non è ancora stata valutata la funzionalità di questa terapia in pazienti con profili simili.
La figura 1 riporta un quadro riassuntivo del profilo istologico e molecolare del tumore. L’analisi istologica conferma la diagnosi di adenocarcinoma duttale ed il sequenziamento genico mostra la presenza di classiche mutazioni di RAS e P53 per cui ad oggi non esistono farmaci mirati. Allo stesso tempo ha permesso di individuare la presenza di mutazioni nel gene TPMT implicato nel metabolismo di alcuni farmaci.
Nella stessa figura è riportata anche l’analisi di eventuali marcatori che possano indicare l’eventuale efficacia delle terapie più usate per il trattamento del tumore al pancreas nonché di terapie in fase di studio. Da tutte queste analisi la potenziale o mancata funzionalità di alcuni farmaci è predetta (Tabella 2). Valutando la tabella che permette di confrontare la predizione con i farmaci realmente somministrati si nota come:
- tra i farmaci suggeriti come non funzionanti dal test vi è la gemcitabina che è risultata tale quando somministrata al paziente
- allo stesso tempo l’oxaliplatino utilizzato in concomitanza al 5-FU ed indicato come dannoso ha caratterizzato una forte immunosoppressione del paziente.
Ad una prima analisi sembrerebbe che il test effettuato abbia un diretto riscontro con la realtà dei fatti.
Alcune Considerazioni finali
Purtroppo quando ho ricevuto questi risultati ero già al funerale di mio padre quindi rimarrò sempre con il dubbio della reale utilità di test simili.
La domanda che mi porterò sempre con me a fronte dei risultati di questo caso è: quanto la tossicità del 5-FU e oxaliplatino (FOLFOX) risultò legata al farmaco e quanto invece alla progressione della malattia? Questo non è purtroppo valutabile su un caso singolo ed è per questo che per ogni trattamento e farmaco è necessario una verifica con sperimentazioni cliniche randomizzate. La semplice esperienza di un paziente non è sufficiente soprattutto in una malattia dalle mille forme come il tumore al pancreas.

Questo caso può essere uno spunto di riflessione per la comunità di pazienti che deve lottare per terapie accessibili a tutti, più efficaci, più personali, meno tossiche e testate adeguatamente. Quanto descritto sembra il libro dei sogni nella condizione economica attuale del Sistema Sanitario Nazionale ma un’analisi attenta forse potrebbe suggerire che dei test preliminari, con i costi che tendono a decrescere, potrebbero risparmiare non solo cure inutili e potenzialmente dannose ma anche soldi.
Condividi questo articolo

Negli ultimi due anni la comunità dei pazienti e dei familiari è bombardata da molteplici messaggi su genomica, biomarcatori, medicina di precisione, … . I mezzi di comunicazione non aiutano molto perché pur di colpire l’attenzione dei lettori utilizzano titoli che lasciano presagire che la cura dei tumori sia dietro l’angolo. Non è vero in generale ma soprattutto non è vero ad oggi per il tumore al pancreas, per il quale le uniche indicazioni per la profilazione molecolare riguardano la valutazione dell’instabilità dei microsatelliti, dovuta ad un deficit nel sistema di riparazione del DNA, 1-3% dei pazienti, e le mutazioni dei geni BRCA, 5-10% dei pazienti. Mentre la prima indicazione apre le porte all’utilizzo dell’immunoterapia, la seconda permette di inserire i pazienti in programmi di screening ad hoc. Pazienti e familiari naturalmente continuano ad interrogarsi sull’appropriatezza della cure chemioterapiche proposte e si domandano se esistano degli strumenti per meglio calibrare i pochi protoccoli a disposizione, aumentati certamente negli ultimi dieci anni ma non ancora sufficienti. Daniele Maiolo, ricercatore nel settore delle nanotecnologie al Politecnico di Milano, in questo articolo ci descrive un caso reale e, come tiene a precisare, un caso non fa statistica.
Il Problema

Il medico come un sarto. Illustrazione di Catherine Lazure
Il tumore al pancreas è uno dei big killer, uno dei tumori più aggressivi e mortali. Basti pensare che negli USA nel 2017 ha superato per morti il tumore al seno, uno dei tumori più diffusi. Lo sanno molto bene i pazienti ed i loro familiari, che si trovano a fare i conti con questa patologia così severa e per cui non esistono biomarcatori predittivi che possano guidare a priori la scelta della terapia. I pazientei auspicano e sperano di poter fare un’analisi specifica che possibilmente caratterizzi la biologia del proprio tumore e a quali farmaci è sensibile. Molta ricerca si sta facendo in tal senso per riuscire ad ottenere il profilo molecolare del tumore ma i risultati importanti non sono ancora arrivati.
Cos’è la Profilazione Molecolare e su che tessuto viene effettuata
La profilazione molecolare è un’analisi che permette di creare la carta d’identità del tumore: ci dice come il tumore è fatto dal punto di vista molecolare, ossia quali sono i geni, i frammenti di DNA e le proteine che guidano e orchestrano la crescita tumorale e di conseguenza da quali terapie potremmo trarre vantaggio. Potenzialmente conoscendo il profilo molecolare del tumore di un paziente si potrebbe sviluppare, il condizionale è d’obbligo, una terapia specifica ed adatta allo specifico caso, o quantomeno utilizzare una terapia verosimilmente più appropriata tra quelle esistenti. Ad oggi non avendo una qualche indicazione su come poter associare una cura ad una tipologia tipologia di tumore l’oncologo sceglie la terapia sulla base dello stato di salute del paziente, dei precedenti trattamenti somministrati e della propria esperienza.
Per eseguire una profilazione servono le cellule tumorali o il materiale da queste rilasciato. Le cellule possono essere ottenute partendo da tessuto proveniente dal tumore espiantato, da biopsie tumorali derivanti dal tumore primario o da metastasi e da ciò che viene chiamata biopsia liquida. Quest’ultima permetterebbe, facendo un semplice prelievo del sangue e con le opportune tecniche diagnostiche, di ottenere informazioni riguardanti il profilo molecolare del tumore originale evitando indagini invasive come le biopsie. Il limite delle biopsie liquide è legato alla diluizione del materiale rilasciato dal tumore nei fluidi, attività questa paragonabile alla ricerca di un ago in un pagliaio. Al momento esistono solo sperimentazioni nel campo delle biopsie liquide per il pancreas, niente a livello di pratica clinica.
Il Contesto Scientifico
Recentemente si è visto un proliferare di test poco specifici per il tumore al pancreas che promettono di dare un aiuto nella scelta terapeutica ma cui è bene dare una valutazione molto attenta facendosi consigliare dal proprio oncologo di fiducia. Ad Agosto 2017 alcuni test genetici della Foundation-One sono stati approvati dalla FDA, l’agenzia americana preposta all’autorizzazione di nuovi farmaci negli USA, per alcune forme tumorali, il tumore del pancreas non è tra questi. Questi test si preoccupano fondamentalmente di evidenziare la presenza di mutazioni nel DNA. Altri test, ad esempio quello promosso dall’associazione PANCAN nell’ambito del trial Know Your Tumor®, hanno un approccio più olistico e oltre a valutare le mutazioni al DNA cercano di capire se ci sono marcatori proteici che possono indirizzare la scelta della terapia, come ad esempio nel caso dell’immunoterapia che si è visto funzionare meglio in pazienti in cui le proteine implicate nella riparazione del DNA sono mutate o non presenti.
Ma qual è la reale utilità di questi test?
Innanzitutto è bene ricordare che sono state condotte poche sperimentazioni cliniche specifiche per il tumore al pancreas in questo contesto, un esempio ne è lo studio recentemente pubblicato e visionabile all’indirizzo: http://jgo.amegroups.com/article/view/16797/13875. Quindi se si decide di optare per l’esecuzione di uno di questi test bisogna essere consapevoli che sono sperimentali e non clinicamente approvati. Questo ha delle implicazioni pratiche, ossia anche dopo aver fatto il test ed aver determinato la presenza di mutazioni o altri biomarcatori, l’oncologo difficilmente nel caso del tumore del pancreas potrà prescrivere un farmaco che operi come una terapia mirata per lo specifico caso. I risultati sperimentali e clinici nel campo del tumore al pancreas per quanto concerne le terapie mirata o di precisione non sono molto confortanti ad oggi. Per esempio uno studio condotto dal Memorial Sloan Kettering Cancer Center ha evidenziato come solo l’uno per cento di pazienti beneficia di approcci di medicina personalizzata appunto perché non esistono indicazioni e farmaci approvati dagli organismi di controllo come la FDA americana e l’AIFA italiana. In più bisogna ricordare che per i geni che più ricorrentemente mutati nel tumore al pancreas, RAS e P53, non esistono farmaci specifici, precludendo ciò la possibilità di terapie mirate. La comunità medica scientifica non ha ancora raggiunto un consenso sull’utilità o meno di questi test per il tumore del pancreas anche se sul mercato cominciano ad apparire aziende che promettono cure specifiche per il tumore del pancreas su base genetica. Ma è importante per i pazienti sapere che si sta lavorando a livello di ricerca di base e di sperimentazioni cliniche per capire chi possa beneficiare di questi approcci. Basti pensare alla recente pubblicazione dell’atlante delle mutazioni dei tumori, al lavoro del PANCAN Tumor Atlas e al mega studio clinico condotto dall’istituto tumori americano NCI-match. Tutto questo apre una ragionevole speranza che nel giro di qualche anno cominceremo ad avere più informazioni in tale senso e probabilmente, quello che ad oggi è un sogno, una terapia mirata su misura del paziente, possa avvicinarsi in qualche forma alla realtà come è successo per altre forme tumorali.
Un Caso Reale
Sperando possa essere d’aiuto racconterò l’esperienza che ha avuto mio padre:
Luglio del 2016 a 59 anni viene diagnosticato un tumore alla testa del pancreas resecabile. Il tumore viene rimosso e l’istologia conferma un adenocarcinoma duttale con presenza microscopica di cellule di adenocarcinoma su un margine tumorale.
Nel Settembre 2016 il paziente comincia la terapia adiuvante in prima istanza con Gemcitabina per tre mesi. La prima ristadiazione al termine della chemio adiuvante dimostrava l’assenza di malattia.
A Gennaio 2017 per 40 giorni viene eseguito un ciclo di chemio-radio concomitante a base di capecitabina e radioterapia seguito da ulteriori due cicli di chemio.

Ad Aprile 2017 viene eseguita una ristadiazione al termine della chemio che riporta la comparsa di metastasi peritoneali.
A Maggio 2017 l’oncologo decide così di cominciare la una terapia di seconda linea a base di 5-FU e oxaliplatino (FOLFOX).
A questo punto per individuare strade alternative in caso di fallimento della terapia di seconda linea che potessero portare all’inclusione in qualche trial clinico ci siamo rivolti ad un laboratorio privato per effettuare una profilazione molecolare del tumore. Un frammento dell’espianto tumorale ottenuto in occasione dell’intervento chirurgico viene quindi spedito per effettuare delle analisi in cieco, ossia il laboratorio non sa di precedenti terapie e l’iter terapeutico del paziente. Nel frattempo il paziente ha una severa soppressione immunitaria accompagnata da una colangite che provoca una sepsi.
Il paziente riesce quindi a terminare un solo ciclo di chemio di seconda linea. La malattia progredisce portando all’ostruzione del duodeno e dello stomaco provocando il decesso del paziente nel Luglio 2017.
Pochi giorni dopo il decesso arrivano gli esiti della profilazione molecolare, che portano ad una indicazione della funzionalità o meno di alcuni farmaci, vediamola in dettaglio.

Figura 1 Prospetto riassuntivo della profilazione molecolare ed istologica del tumore (adattato da ONCODNA):
Nel Riquadro Pathology in alto a sinistra viene riporta l’analisi istologica che conferma il tumore pancreatico,
Nel Riquadro Next Generation Sequencing a destra viene descritto il profilo di mutazione genetiche presenti nel tumore.
Nel Riquadro Package In basso a sinistra la profilazione proteomica di alcuni marcatori di efficacia di terapia valutati,
Nel Riquadro Comprehensive Summary al centro viene riportato un riassunto del meccanismo di azione dei farmaci immunoterapici diretti contro la proteina PD-1 e PD-L1. In particolare i tumori che esprimono alti livelli del PD-L1 riescono a bloccare la funzione delle cellule immunitarie T interagendo con la proteina PD-1 che invia segnali alla cellula che vengono tradotti in un blocco della risposta immunitaria verso il tumore. I farmaci immunoterapici vanno a bloccare questa interazione ripristinando la risposta immunitaria verso il tumore che venendo riconosciuto come corpo estraneo viene attaccato dalle cellule T. Il paziente in questione ha un profilo PD-L1 low, MSI -, CD8+ (vedi Package) che vuol dire rispettivamente bassi livelli della proteina PD-L1, negativo per instabilità di microsatelliti un marker che può indicare la potenziale funzionalità dell’immunoterapia, e alti livelli di cellule T . Questo profilo con due fattori negativi (PD-L1 low e MSI -) ed uno positivo (CD-8 +) rende non valutabile la possibile funzionalità dell’immunoterapia in quanto non è ancora stata valutata la funzionalità di questa terapia in pazienti con profili simili.
La figura 1 riporta un quadro riassuntivo del profilo istologico e molecolare del tumore. L’analisi istologica conferma la diagnosi di adenocarcinoma duttale ed il sequenziamento genico mostra la presenza di classiche mutazioni di RAS e P53 per cui ad oggi non esistono farmaci mirati. Allo stesso tempo ha permesso di individuare la presenza di mutazioni nel gene TPMT implicato nel metabolismo di alcuni farmaci.
Nella stessa figura è riportata anche l’analisi di eventuali marcatori che possano indicare l’eventuale efficacia delle terapie più usate per il trattamento del tumore al pancreas nonché di terapie in fase di studio. Da tutte queste analisi la potenziale o mancata funzionalità di alcuni farmaci è predetta (Tabella 2). Valutando la tabella che permette di confrontare la predizione con i farmaci realmente somministrati si nota come:
- tra i farmaci suggeriti come non funzionanti dal test vi è la gemcitabina che è risultata tale quando somministrata al paziente
- allo stesso tempo l’oxaliplatino utilizzato in concomitanza al 5-FU ed indicato come dannoso ha caratterizzato una forte immunosoppressione del paziente.
Ad una prima analisi sembrerebbe che il test effettuato abbia un diretto riscontro con la realtà dei fatti.
Alcune Considerazioni finali
Purtroppo quando ho ricevuto questi risultati ero già al funerale di mio padre quindi rimarrò sempre con il dubbio della reale utilità di test simili.
La domanda che mi porterò sempre con me a fronte dei risultati di questo caso è: quanto la tossicità del 5-FU e oxaliplatino (FOLFOX) risultò legata al farmaco e quanto invece alla progressione della malattia? Questo non è purtroppo valutabile su un caso singolo ed è per questo che per ogni trattamento e farmaco è necessario una verifica con sperimentazioni cliniche randomizzate. La semplice esperienza di un paziente non è sufficiente soprattutto in una malattia dalle mille forme come il tumore al pancreas.

Questo caso può essere uno spunto di riflessione per la comunità di pazienti che deve lottare per terapie accessibili a tutti, più efficaci, più personali, meno tossiche e testate adeguatamente. Quanto descritto sembra il libro dei sogni nella condizione economica attuale del Sistema Sanitario Nazionale ma un’analisi attenta forse potrebbe suggerire che dei test preliminari, con i costi che tendono a decrescere, potrebbero risparmiare non solo cure inutili e potenzialmente dannose ma anche soldi.
Condividi questo articolo

Negli ultimi due anni la comunità dei pazienti e dei familiari è bombardata da molteplici messaggi su genomica, biomarcatori, medicina di precisione, … . I mezzi di comunicazione non aiutano molto perché pur di colpire l’attenzione dei lettori utilizzano titoli che lasciano presagire che la cura dei tumori sia dietro l’angolo. Non è vero in generale ma soprattutto non è vero ad oggi per il tumore al pancreas, per il quale le uniche indicazioni per la profilazione molecolare riguardano la valutazione dell’instabilità dei microsatelliti, dovuta ad un deficit nel sistema di riparazione del DNA, 1-3% dei pazienti, e le mutazioni dei geni BRCA, 5-10% dei pazienti. Mentre la prima indicazione apre le porte all’utilizzo dell’immunoterapia, la seconda permette di inserire i pazienti in programmi di screening ad hoc. Pazienti e familiari naturalmente continuano ad interrogarsi sull’appropriatezza della cure chemioterapiche proposte e si domandano se esistano degli strumenti per meglio calibrare i pochi protoccoli a disposizione, aumentati certamente negli ultimi dieci anni ma non ancora sufficienti. Daniele Maiolo, ricercatore nel settore delle nanotecnologie al Politecnico di Milano, in questo articolo ci descrive un caso reale e, come tiene a precisare, un caso non fa statistica.
Il Problema

Il medico come un sarto. Illustrazione di Catherine Lazure
Il tumore al pancreas è uno dei big killer, uno dei tumori più aggressivi e mortali. Basti pensare che negli USA nel 2017 ha superato per morti il tumore al seno, uno dei tumori più diffusi. Lo sanno molto bene i pazienti ed i loro familiari, che si trovano a fare i conti con questa patologia così severa e per cui non esistono biomarcatori predittivi che possano guidare a priori la scelta della terapia. I pazientei auspicano e sperano di poter fare un’analisi specifica che possibilmente caratterizzi la biologia del proprio tumore e a quali farmaci è sensibile. Molta ricerca si sta facendo in tal senso per riuscire ad ottenere il profilo molecolare del tumore ma i risultati importanti non sono ancora arrivati.
Cos’è la Profilazione Molecolare e su che tessuto viene effettuata
La profilazione molecolare è un’analisi che permette di creare la carta d’identità del tumore: ci dice come il tumore è fatto dal punto di vista molecolare, ossia quali sono i geni, i frammenti di DNA e le proteine che guidano e orchestrano la crescita tumorale e di conseguenza da quali terapie potremmo trarre vantaggio. Potenzialmente conoscendo il profilo molecolare del tumore di un paziente si potrebbe sviluppare, il condizionale è d’obbligo, una terapia specifica ed adatta allo specifico caso, o quantomeno utilizzare una terapia verosimilmente più appropriata tra quelle esistenti. Ad oggi non avendo una qualche indicazione su come poter associare una cura ad una tipologia tipologia di tumore l’oncologo sceglie la terapia sulla base dello stato di salute del paziente, dei precedenti trattamenti somministrati e della propria esperienza.
Per eseguire una profilazione servono le cellule tumorali o il materiale da queste rilasciato. Le cellule possono essere ottenute partendo da tessuto proveniente dal tumore espiantato, da biopsie tumorali derivanti dal tumore primario o da metastasi e da ciò che viene chiamata biopsia liquida. Quest’ultima permetterebbe, facendo un semplice prelievo del sangue e con le opportune tecniche diagnostiche, di ottenere informazioni riguardanti il profilo molecolare del tumore originale evitando indagini invasive come le biopsie. Il limite delle biopsie liquide è legato alla diluizione del materiale rilasciato dal tumore nei fluidi, attività questa paragonabile alla ricerca di un ago in un pagliaio. Al momento esistono solo sperimentazioni nel campo delle biopsie liquide per il pancreas, niente a livello di pratica clinica.
Il Contesto Scientifico
Recentemente si è visto un proliferare di test poco specifici per il tumore al pancreas che promettono di dare un aiuto nella scelta terapeutica ma cui è bene dare una valutazione molto attenta facendosi consigliare dal proprio oncologo di fiducia. Ad Agosto 2017 alcuni test genetici della Foundation-One sono stati approvati dalla FDA, l’agenzia americana preposta all’autorizzazione di nuovi farmaci negli USA, per alcune forme tumorali, il tumore del pancreas non è tra questi. Questi test si preoccupano fondamentalmente di evidenziare la presenza di mutazioni nel DNA. Altri test, ad esempio quello promosso dall’associazione PANCAN nell’ambito del trial Know Your Tumor®, hanno un approccio più olistico e oltre a valutare le mutazioni al DNA cercano di capire se ci sono marcatori proteici che possono indirizzare la scelta della terapia, come ad esempio nel caso dell’immunoterapia che si è visto funzionare meglio in pazienti in cui le proteine implicate nella riparazione del DNA sono mutate o non presenti.
Ma qual è la reale utilità di questi test?
Innanzitutto è bene ricordare che sono state condotte poche sperimentazioni cliniche specifiche per il tumore al pancreas in questo contesto, un esempio ne è lo studio recentemente pubblicato e visionabile all’indirizzo: http://jgo.amegroups.com/article/view/16797/13875. Quindi se si decide di optare per l’esecuzione di uno di questi test bisogna essere consapevoli che sono sperimentali e non clinicamente approvati. Questo ha delle implicazioni pratiche, ossia anche dopo aver fatto il test ed aver determinato la presenza di mutazioni o altri biomarcatori, l’oncologo difficilmente nel caso del tumore del pancreas potrà prescrivere un farmaco che operi come una terapia mirata per lo specifico caso. I risultati sperimentali e clinici nel campo del tumore al pancreas per quanto concerne le terapie mirata o di precisione non sono molto confortanti ad oggi. Per esempio uno studio condotto dal Memorial Sloan Kettering Cancer Center ha evidenziato come solo l’uno per cento di pazienti beneficia di approcci di medicina personalizzata appunto perché non esistono indicazioni e farmaci approvati dagli organismi di controllo come la FDA americana e l’AIFA italiana. In più bisogna ricordare che per i geni che più ricorrentemente mutati nel tumore al pancreas, RAS e P53, non esistono farmaci specifici, precludendo ciò la possibilità di terapie mirate. La comunità medica scientifica non ha ancora raggiunto un consenso sull’utilità o meno di questi test per il tumore del pancreas anche se sul mercato cominciano ad apparire aziende che promettono cure specifiche per il tumore del pancreas su base genetica. Ma è importante per i pazienti sapere che si sta lavorando a livello di ricerca di base e di sperimentazioni cliniche per capire chi possa beneficiare di questi approcci. Basti pensare alla recente pubblicazione dell’atlante delle mutazioni dei tumori, al lavoro del PANCAN Tumor Atlas e al mega studio clinico condotto dall’istituto tumori americano NCI-match. Tutto questo apre una ragionevole speranza che nel giro di qualche anno cominceremo ad avere più informazioni in tale senso e probabilmente, quello che ad oggi è un sogno, una terapia mirata su misura del paziente, possa avvicinarsi in qualche forma alla realtà come è successo per altre forme tumorali.
Un Caso Reale
Sperando possa essere d’aiuto racconterò l’esperienza che ha avuto mio padre:
Luglio del 2016 a 59 anni viene diagnosticato un tumore alla testa del pancreas resecabile. Il tumore viene rimosso e l’istologia conferma un adenocarcinoma duttale con presenza microscopica di cellule di adenocarcinoma su un margine tumorale.
Nel Settembre 2016 il paziente comincia la terapia adiuvante in prima istanza con Gemcitabina per tre mesi. La prima ristadiazione al termine della chemio adiuvante dimostrava l’assenza di malattia.
A Gennaio 2017 per 40 giorni viene eseguito un ciclo di chemio-radio concomitante a base di capecitabina e radioterapia seguito da ulteriori due cicli di chemio.

Ad Aprile 2017 viene eseguita una ristadiazione al termine della chemio che riporta la comparsa di metastasi peritoneali.
A Maggio 2017 l’oncologo decide così di cominciare la una terapia di seconda linea a base di 5-FU e oxaliplatino (FOLFOX).
A questo punto per individuare strade alternative in caso di fallimento della terapia di seconda linea che potessero portare all’inclusione in qualche trial clinico ci siamo rivolti ad un laboratorio privato per effettuare una profilazione molecolare del tumore. Un frammento dell’espianto tumorale ottenuto in occasione dell’intervento chirurgico viene quindi spedito per effettuare delle analisi in cieco, ossia il laboratorio non sa di precedenti terapie e l’iter terapeutico del paziente. Nel frattempo il paziente ha una severa soppressione immunitaria accompagnata da una colangite che provoca una sepsi.
Il paziente riesce quindi a terminare un solo ciclo di chemio di seconda linea. La malattia progredisce portando all’ostruzione del duodeno e dello stomaco provocando il decesso del paziente nel Luglio 2017.
Pochi giorni dopo il decesso arrivano gli esiti della profilazione molecolare, che portano ad una indicazione della funzionalità o meno di alcuni farmaci, vediamola in dettaglio.

Figura 1 Prospetto riassuntivo della profilazione molecolare ed istologica del tumore (adattato da ONCODNA):
Nel Riquadro Pathology in alto a sinistra viene riporta l’analisi istologica che conferma il tumore pancreatico,
Nel Riquadro Next Generation Sequencing a destra viene descritto il profilo di mutazione genetiche presenti nel tumore.
Nel Riquadro Package In basso a sinistra la profilazione proteomica di alcuni marcatori di efficacia di terapia valutati,
Nel Riquadro Comprehensive Summary al centro viene riportato un riassunto del meccanismo di azione dei farmaci immunoterapici diretti contro la proteina PD-1 e PD-L1. In particolare i tumori che esprimono alti livelli del PD-L1 riescono a bloccare la funzione delle cellule immunitarie T interagendo con la proteina PD-1 che invia segnali alla cellula che vengono tradotti in un blocco della risposta immunitaria verso il tumore. I farmaci immunoterapici vanno a bloccare questa interazione ripristinando la risposta immunitaria verso il tumore che venendo riconosciuto come corpo estraneo viene attaccato dalle cellule T. Il paziente in questione ha un profilo PD-L1 low, MSI -, CD8+ (vedi Package) che vuol dire rispettivamente bassi livelli della proteina PD-L1, negativo per instabilità di microsatelliti un marker che può indicare la potenziale funzionalità dell’immunoterapia, e alti livelli di cellule T . Questo profilo con due fattori negativi (PD-L1 low e MSI -) ed uno positivo (CD-8 +) rende non valutabile la possibile funzionalità dell’immunoterapia in quanto non è ancora stata valutata la funzionalità di questa terapia in pazienti con profili simili.
La figura 1 riporta un quadro riassuntivo del profilo istologico e molecolare del tumore. L’analisi istologica conferma la diagnosi di adenocarcinoma duttale ed il sequenziamento genico mostra la presenza di classiche mutazioni di RAS e P53 per cui ad oggi non esistono farmaci mirati. Allo stesso tempo ha permesso di individuare la presenza di mutazioni nel gene TPMT implicato nel metabolismo di alcuni farmaci.
Nella stessa figura è riportata anche l’analisi di eventuali marcatori che possano indicare l’eventuale efficacia delle terapie più usate per il trattamento del tumore al pancreas nonché di terapie in fase di studio. Da tutte queste analisi la potenziale o mancata funzionalità di alcuni farmaci è predetta (Tabella 2). Valutando la tabella che permette di confrontare la predizione con i farmaci realmente somministrati si nota come:
- tra i farmaci suggeriti come non funzionanti dal test vi è la gemcitabina che è risultata tale quando somministrata al paziente
- allo stesso tempo l’oxaliplatino utilizzato in concomitanza al 5-FU ed indicato come dannoso ha caratterizzato una forte immunosoppressione del paziente.
Ad una prima analisi sembrerebbe che il test effettuato abbia un diretto riscontro con la realtà dei fatti.
Alcune Considerazioni finali
Purtroppo quando ho ricevuto questi risultati ero già al funerale di mio padre quindi rimarrò sempre con il dubbio della reale utilità di test simili.
La domanda che mi porterò sempre con me a fronte dei risultati di questo caso è: quanto la tossicità del 5-FU e oxaliplatino (FOLFOX) risultò legata al farmaco e quanto invece alla progressione della malattia? Questo non è purtroppo valutabile su un caso singolo ed è per questo che per ogni trattamento e farmaco è necessario una verifica con sperimentazioni cliniche randomizzate. La semplice esperienza di un paziente non è sufficiente soprattutto in una malattia dalle mille forme come il tumore al pancreas.

Questo caso può essere uno spunto di riflessione per la comunità di pazienti che deve lottare per terapie accessibili a tutti, più efficaci, più personali, meno tossiche e testate adeguatamente. Quanto descritto sembra il libro dei sogni nella condizione economica attuale del Sistema Sanitario Nazionale ma un’analisi attenta forse potrebbe suggerire che dei test preliminari, con i costi che tendono a decrescere, potrebbero risparmiare non solo cure inutili e potenzialmente dannose ma anche soldi.