Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.
AIFA ha approvato lo studio randomizzato di Fase II di confronto tra la chemioterapia pre-operatoria, o neoadiuvante, mFOLFIRINOX con la PAXG in pazienti affetti da adenocarcinoma del pancreas resecabile e borderline, ovvero ai limiti della resecabilità. Lo studio è randomizzato, indipendente, finanziato da alcune associazioni pazienti e non da aziende farmaceutiche, e multicentro, con la partecipazione di 22 ospedali distribuiti sul territorio nazionale. Lo studio ha anche il supporto della società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
Motivazioni e organizzazione dello studio PACT-21
Il contesto attuale
Ad oggi il riferimento per i tumori resecabili è l’intervento chirurgico seguito dalla somministrazione della chemio. Lo schema riferimento per la chemioterapia post-intervento, chemio adiuvante, è l’mFOLFIRINOX, FOLFIRINOX modificato, protocollo che migliora significativamente la sopravvivenza dei pazienti rispetto al trattamento con la sola gemcitabina.
Se da un lato è vero che il trattamento chemioterapico adiuvante prolunga la sopravvivenza complessiva dei pazienti affetti da tumore al pancreas sottoposti a intervento chirurgico, purtroppo il 65-90% dei pazienti sottoposti a intervento sviluppa una recidiva a 2 anni dall’intervento resettivo.
Va anche tenuto conto che molti dei pazienti sottoposti a intervento non riescono a beneficiare della chemio adiuvante a causa di complicazioni e stato di forma fisica non adeguato.
I risultati di un precedente studio randomizzato multicentrico di Fase II italiano condotto nei pazienti con tumore del pancreas resecabile, il PACT-15, ha riportato un raddoppiamento della sopravvivenza a 5 anni con l’impiego della chemioterapia per 3 mesi prima e 3 mesi dopo l’intervento rispetto alla stessa chemioterapia utilizzata per 6 mesi dopo l’intervento.
Queste sono le premesse per cercare di validare un approccio differente che risparmi interventi non efficaci visto l’attuale tasso di recidive.
Perché lo studio clinico PACT-21
In tale contesto la chemioterapia pre-operatoria, chemio neoadiuvante, può offrire una serie di vantaggi teorici in quanto permette di trattare precocemente eventuali micrometastasi, aumenta negli interventi chirurgici il tasso di resezione R0, mancanza di cellule tumorali sulla trancia di resezione, elimina i linfonodi metastatici, N0, e permette una migliore diffusione del farmaco nei tessuti.
Ad oggi ci sono scarsissimi dati per definire quale schema di chemioterapia sia più efficace nell’affrontare la malattia e non è chiaro quale sia la durata ottimale della chemio pre-operatoria (4 o 6 mesi).
Nel 2018 sono stati pubblicati i risultati di un nuovo protocollo per la cura del tumore del pancreas localmente avanzato e metastatico, lo schema chemioterapico PAXG (cisplatino, Abraxane (nab-paclitaxel), capecitabina e gemcitabina) che ha ottenuto risultati promettenti in uno studio randomizzato di Fase II in cui è stato paragonato al trattamento con gemcitabina + Abraxane (nab-paclitaxel).
Da questi risultati nasce l’idea di confrontare l’efficacia dei protocolli mFOLFIRINOX e PAXG nel contesto dei tumori del pancreas resecabili o borderline nello studio clinico randomizzato di Fase II PACT-21.
Come funziona lo studio PACT-21
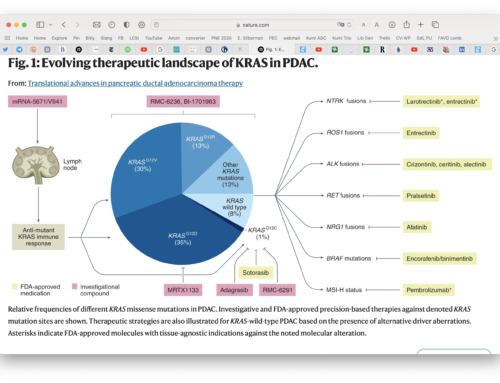
Lo schema allegato mostra la randomizzazione-1 prima della chemio neoadiuavante per assegnare i pazienti al braccio PAXG o al braccio mFOLFIRINOX. Dopo 4 mesi di chemioterapia, la ri-stadiazione valuta la risposta della malattia. Per i pazienti che hanno progressione di malattia si valutano altre opzioni chemioterapiche e si evita un intervento che con alta probabilità porterebbe ad una recidiva. Per i pazienti che non progrediscono viene effettuata la randomizzazione-2 assegnandoli a due ulteriori bracci: uno che va all’intervento subito per poi ricevere 2 mesi di chemio dopo la chirurgia; l’altro invece prosegue con due mesi di chemioterapia e, alla fine dei 6 mesi di chemio viene di nuovo sottoposto a stadiazione per decidere se andare all’intervento o meno.

Alcune importanti considerazioni
PACT-21 è uno studio randomizzato, il riferimento ottimale a livello scientifico per validare l’efficacia di un protocollo di cura.
PACT-21 è uno studio clinico indipendente, in altre parole non sarà finanziato da aziende farmaceutiche, quindi l’impianto progettuale dello studio è focalizzato sui benefici per i pazienti ed è esente da influenze di ritorno economico del progetto. Per queste ragioni lo studio sarà finanziato dalle associazioni pazienti, tra queste:
- Codice Viola
- My Everest
- Pierluigi Natalucci
ed è ragionevole aspettarsi che la comunità dei pazienti contribuisca economicamente alla realizzazione dello studio.
Inoltre lo studio è sponsorizzato dalla società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
PACT-21 è uno studio multicentro e coinvolgerà 22 ospedali italiani, alcuni di questi nel centro-sud del paese. Questo è un risultato straordinario perché vede la partecipazione di tutti i maggiori centri insieme ad altri sparsi per l’Italia dando più credibilità e qualità scientifica ai risultati che verranno raggiunti. L’importante coinvolgimento di alcuni ospedali del centro-sud contribuirà a diminuire lo svantaggio in termini di offerta di cura per quelle regioni del nostro paese.
Di seguito la lista degli ospedali partecipanti a PACT-21 che dopo l’approvazione dell’AIFA dovranno attivare le procedure interne di approvazione dei propri comitati etici. Dopo l’approvazione dei propri comitati etici i singoli ospedali potranno cominciare a coinvolgere i pazienti nello studio.
Lista degli ospedali partecipanti
- Ospedale S. Raffaele di Milano, Dr. Michele Reni (Centro Coordinatore)
- Papa Giovanni XXIII di Bergamo, Dr Barbara Merelli
- Ospedale Sant’Orsola di Bologna, Dr.ssa Maria Cristina Di Marco
- Ospedale Careggi, Dr.ssa Elisa Giommoni
- Istituto Oncologico Romagnolo-Meldola, Dr. Luca Frassinetti
- Ospedale Humanitas, Milano Dr.ssa Lorenza Rimassa
- Ospedale Niguarda-Milano, Dr.ssa Katia Bencardino
- Istituto Oncologico Veneto-Padova, Dr.ssa Sara Lonardi
- Università di Pisa, Dr. Enrico Vasile
- Policlinico Gemelli-Roma, Dr. Giampaolo Tortora
- Mauriziano-Torino, Dr. Alessandro Ferrero
- Ospedale di Verona, Dr Michele Milella
- Ospedale di Vicenza, Dr. Giuseppe Aprile*
- Ospedale di Aviano, Dr.ssa Angela Buonadonna*
- Istituto Oncologico di Bari, Dr. Nicola Silvestris*
- Poliambulanza di Brescia, Dr. Alberto Zaniboni*
- Policlinico di Monserrato-Cagliari, Dr. Mario Scartozzi*
- Ospedale di Macerata, Dr. Nicola Battelli*
- Ospedale di Napoli Federico II, Dr. Roberto Bianco*
- Ospedale Civico di Palermo, Dr Livio Blasi*
- Ospedale di Treviso, Dr. Marco Massani
- Ospedale di Udine, Dr.ssa Nicoletta Pella*
* solo oncologia
Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.
Condividi questo articolo

Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.
AIFA ha approvato lo studio randomizzato di Fase II di confronto tra la chemioterapia pre-operatoria, o neoadiuvante, mFOLFIRINOX con la PAXG in pazienti affetti da adenocarcinoma del pancreas resecabile e borderline, ovvero ai limiti della resecabilità. Lo studio è randomizzato, indipendente, finanziato da alcune associazioni pazienti e non da aziende farmaceutiche, e multicentro, con la partecipazione di 22 ospedali distribuiti sul territorio nazionale. Lo studio ha anche il supporto della società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
Motivazioni e organizzazione dello studio PACT-21
Il contesto attuale
Ad oggi il riferimento per i tumori resecabili è l’intervento chirurgico seguito dalla somministrazione della chemio. Lo schema riferimento per la chemioterapia post-intervento, chemio adiuvante, è l’mFOLFIRINOX, FOLFIRINOX modificato, protocollo che migliora significativamente la sopravvivenza dei pazienti rispetto al trattamento con la sola gemcitabina.
Se da un lato è vero che il trattamento chemioterapico adiuvante prolunga la sopravvivenza complessiva dei pazienti affetti da tumore al pancreas sottoposti a intervento chirurgico, purtroppo il 65-90% dei pazienti sottoposti a intervento sviluppa una recidiva a 2 anni dall’intervento resettivo.
Va anche tenuto conto che molti dei pazienti sottoposti a intervento non riescono a beneficiare della chemio adiuvante a causa di complicazioni e stato di forma fisica non adeguato.
I risultati di un precedente studio randomizzato multicentrico di Fase II italiano condotto nei pazienti con tumore del pancreas resecabile, il PACT-15, ha riportato un raddoppiamento della sopravvivenza a 5 anni con l’impiego della chemioterapia per 3 mesi prima e 3 mesi dopo l’intervento rispetto alla stessa chemioterapia utilizzata per 6 mesi dopo l’intervento.
Queste sono le premesse per cercare di validare un approccio differente che risparmi interventi non efficaci visto l’attuale tasso di recidive.
Perché lo studio clinico PACT-21
In tale contesto la chemioterapia pre-operatoria, chemio neoadiuvante, può offrire una serie di vantaggi teorici in quanto permette di trattare precocemente eventuali micrometastasi, aumenta negli interventi chirurgici il tasso di resezione R0, mancanza di cellule tumorali sulla trancia di resezione, elimina i linfonodi metastatici, N0, e permette una migliore diffusione del farmaco nei tessuti.
Ad oggi ci sono scarsissimi dati per definire quale schema di chemioterapia sia più efficace nell’affrontare la malattia e non è chiaro quale sia la durata ottimale della chemio pre-operatoria (4 o 6 mesi).
Nel 2018 sono stati pubblicati i risultati di un nuovo protocollo per la cura del tumore del pancreas localmente avanzato e metastatico, lo schema chemioterapico PAXG (cisplatino, Abraxane (nab-paclitaxel), capecitabina e gemcitabina) che ha ottenuto risultati promettenti in uno studio randomizzato di Fase II in cui è stato paragonato al trattamento con gemcitabina + Abraxane (nab-paclitaxel).
Da questi risultati nasce l’idea di confrontare l’efficacia dei protocolli mFOLFIRINOX e PAXG nel contesto dei tumori del pancreas resecabili o borderline nello studio clinico randomizzato di Fase II PACT-21.
Come funziona lo studio PACT-21
Lo schema allegato mostra la randomizzazione-1 prima della chemio neoadiuavante per assegnare i pazienti al braccio PAXG o al braccio mFOLFIRINOX. Dopo 4 mesi di chemioterapia, la ri-stadiazione valuta la risposta della malattia. Per i pazienti che hanno progressione di malattia si valutano altre opzioni chemioterapiche e si evita un intervento che con alta probabilità porterebbe ad una recidiva. Per i pazienti che non progrediscono viene effettuata la randomizzazione-2 assegnandoli a due ulteriori bracci: uno che va all’intervento subito per poi ricevere 2 mesi di chemio dopo la chirurgia; l’altro invece prosegue con due mesi di chemioterapia e, alla fine dei 6 mesi di chemio viene di nuovo sottoposto a stadiazione per decidere se andare all’intervento o meno.

Alcune importanti considerazioni
PACT-21 è uno studio randomizzato, il riferimento ottimale a livello scientifico per validare l’efficacia di un protocollo di cura.
PACT-21 è uno studio clinico indipendente, in altre parole non sarà finanziato da aziende farmaceutiche, quindi l’impianto progettuale dello studio è focalizzato sui benefici per i pazienti ed è esente da influenze di ritorno economico del progetto. Per queste ragioni lo studio sarà finanziato dalle associazioni pazienti, tra queste:
- Codice Viola
- My Everest
- Pierluigi Natalucci
ed è ragionevole aspettarsi che la comunità dei pazienti contribuisca economicamente alla realizzazione dello studio.
Inoltre lo studio è sponsorizzato dalla società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
PACT-21 è uno studio multicentro e coinvolgerà 22 ospedali italiani, alcuni di questi nel centro-sud del paese. Questo è un risultato straordinario perché vede la partecipazione di tutti i maggiori centri insieme ad altri sparsi per l’Italia dando più credibilità e qualità scientifica ai risultati che verranno raggiunti. L’importante coinvolgimento di alcuni ospedali del centro-sud contribuirà a diminuire lo svantaggio in termini di offerta di cura per quelle regioni del nostro paese.
Di seguito la lista degli ospedali partecipanti a PACT-21 che dopo l’approvazione dell’AIFA dovranno attivare le procedure interne di approvazione dei propri comitati etici. Dopo l’approvazione dei propri comitati etici i singoli ospedali potranno cominciare a coinvolgere i pazienti nello studio.
Lista degli ospedali partecipanti
- Ospedale S. Raffaele di Milano, Dr. Michele Reni (Centro Coordinatore)
- Papa Giovanni XXIII di Bergamo, Dr Barbara Merelli
- Ospedale Sant’Orsola di Bologna, Dr.ssa Maria Cristina Di Marco
- Ospedale Careggi, Dr.ssa Elisa Giommoni
- Istituto Oncologico Romagnolo-Meldola, Dr. Luca Frassinetti
- Ospedale Humanitas, Milano Dr.ssa Lorenza Rimassa
- Ospedale Niguarda-Milano, Dr.ssa Katia Bencardino
- Istituto Oncologico Veneto-Padova, Dr.ssa Sara Lonardi
- Università di Pisa, Dr. Enrico Vasile
- Policlinico Gemelli-Roma, Dr. Giampaolo Tortora
- Mauriziano-Torino, Dr. Alessandro Ferrero
- Ospedale di Verona, Dr Michele Milella
- Ospedale di Vicenza, Dr. Giuseppe Aprile*
- Ospedale di Aviano, Dr.ssa Angela Buonadonna*
- Istituto Oncologico di Bari, Dr. Nicola Silvestris*
- Poliambulanza di Brescia, Dr. Alberto Zaniboni*
- Policlinico di Monserrato-Cagliari, Dr. Mario Scartozzi*
- Ospedale di Macerata, Dr. Nicola Battelli*
- Ospedale di Napoli Federico II, Dr. Roberto Bianco*
- Ospedale Civico di Palermo, Dr Livio Blasi*
- Ospedale di Treviso, Dr. Marco Massani
- Ospedale di Udine, Dr.ssa Nicoletta Pella*
* solo oncologia
Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.
Condividi questo articolo

Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.
AIFA ha approvato lo studio randomizzato di Fase II di confronto tra la chemioterapia pre-operatoria, o neoadiuvante, mFOLFIRINOX con la PAXG in pazienti affetti da adenocarcinoma del pancreas resecabile e borderline, ovvero ai limiti della resecabilità. Lo studio è randomizzato, indipendente, finanziato da alcune associazioni pazienti e non da aziende farmaceutiche, e multicentro, con la partecipazione di 22 ospedali distribuiti sul territorio nazionale. Lo studio ha anche il supporto della società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
Motivazioni e organizzazione dello studio PACT-21
Il contesto attuale
Ad oggi il riferimento per i tumori resecabili è l’intervento chirurgico seguito dalla somministrazione della chemio. Lo schema riferimento per la chemioterapia post-intervento, chemio adiuvante, è l’mFOLFIRINOX, FOLFIRINOX modificato, protocollo che migliora significativamente la sopravvivenza dei pazienti rispetto al trattamento con la sola gemcitabina.
Se da un lato è vero che il trattamento chemioterapico adiuvante prolunga la sopravvivenza complessiva dei pazienti affetti da tumore al pancreas sottoposti a intervento chirurgico, purtroppo il 65-90% dei pazienti sottoposti a intervento sviluppa una recidiva a 2 anni dall’intervento resettivo.
Va anche tenuto conto che molti dei pazienti sottoposti a intervento non riescono a beneficiare della chemio adiuvante a causa di complicazioni e stato di forma fisica non adeguato.
I risultati di un precedente studio randomizzato multicentrico di Fase II italiano condotto nei pazienti con tumore del pancreas resecabile, il PACT-15, ha riportato un raddoppiamento della sopravvivenza a 5 anni con l’impiego della chemioterapia per 3 mesi prima e 3 mesi dopo l’intervento rispetto alla stessa chemioterapia utilizzata per 6 mesi dopo l’intervento.
Queste sono le premesse per cercare di validare un approccio differente che risparmi interventi non efficaci visto l’attuale tasso di recidive.
Perché lo studio clinico PACT-21
In tale contesto la chemioterapia pre-operatoria, chemio neoadiuvante, può offrire una serie di vantaggi teorici in quanto permette di trattare precocemente eventuali micrometastasi, aumenta negli interventi chirurgici il tasso di resezione R0, mancanza di cellule tumorali sulla trancia di resezione, elimina i linfonodi metastatici, N0, e permette una migliore diffusione del farmaco nei tessuti.
Ad oggi ci sono scarsissimi dati per definire quale schema di chemioterapia sia più efficace nell’affrontare la malattia e non è chiaro quale sia la durata ottimale della chemio pre-operatoria (4 o 6 mesi).
Nel 2018 sono stati pubblicati i risultati di un nuovo protocollo per la cura del tumore del pancreas localmente avanzato e metastatico, lo schema chemioterapico PAXG (cisplatino, Abraxane (nab-paclitaxel), capecitabina e gemcitabina) che ha ottenuto risultati promettenti in uno studio randomizzato di Fase II in cui è stato paragonato al trattamento con gemcitabina + Abraxane (nab-paclitaxel).
Da questi risultati nasce l’idea di confrontare l’efficacia dei protocolli mFOLFIRINOX e PAXG nel contesto dei tumori del pancreas resecabili o borderline nello studio clinico randomizzato di Fase II PACT-21.
Come funziona lo studio PACT-21
Lo schema allegato mostra la randomizzazione-1 prima della chemio neoadiuavante per assegnare i pazienti al braccio PAXG o al braccio mFOLFIRINOX. Dopo 4 mesi di chemioterapia, la ri-stadiazione valuta la risposta della malattia. Per i pazienti che hanno progressione di malattia si valutano altre opzioni chemioterapiche e si evita un intervento che con alta probabilità porterebbe ad una recidiva. Per i pazienti che non progrediscono viene effettuata la randomizzazione-2 assegnandoli a due ulteriori bracci: uno che va all’intervento subito per poi ricevere 2 mesi di chemio dopo la chirurgia; l’altro invece prosegue con due mesi di chemioterapia e, alla fine dei 6 mesi di chemio viene di nuovo sottoposto a stadiazione per decidere se andare all’intervento o meno.

Alcune importanti considerazioni
PACT-21 è uno studio randomizzato, il riferimento ottimale a livello scientifico per validare l’efficacia di un protocollo di cura.
PACT-21 è uno studio clinico indipendente, in altre parole non sarà finanziato da aziende farmaceutiche, quindi l’impianto progettuale dello studio è focalizzato sui benefici per i pazienti ed è esente da influenze di ritorno economico del progetto. Per queste ragioni lo studio sarà finanziato dalle associazioni pazienti, tra queste:
- Codice Viola
- My Everest
- Pierluigi Natalucci
ed è ragionevole aspettarsi che la comunità dei pazienti contribuisca economicamente alla realizzazione dello studio.
Inoltre lo studio è sponsorizzato dalla società scientifica AISP, Associazione Italiana per lo Studio del Pancreas.
PACT-21 è uno studio multicentro e coinvolgerà 22 ospedali italiani, alcuni di questi nel centro-sud del paese. Questo è un risultato straordinario perché vede la partecipazione di tutti i maggiori centri insieme ad altri sparsi per l’Italia dando più credibilità e qualità scientifica ai risultati che verranno raggiunti. L’importante coinvolgimento di alcuni ospedali del centro-sud contribuirà a diminuire lo svantaggio in termini di offerta di cura per quelle regioni del nostro paese.
Di seguito la lista degli ospedali partecipanti a PACT-21 che dopo l’approvazione dell’AIFA dovranno attivare le procedure interne di approvazione dei propri comitati etici. Dopo l’approvazione dei propri comitati etici i singoli ospedali potranno cominciare a coinvolgere i pazienti nello studio.
Lista degli ospedali partecipanti
- Ospedale S. Raffaele di Milano, Dr. Michele Reni (Centro Coordinatore)
- Papa Giovanni XXIII di Bergamo, Dr Barbara Merelli
- Ospedale Sant’Orsola di Bologna, Dr.ssa Maria Cristina Di Marco
- Ospedale Careggi, Dr.ssa Elisa Giommoni
- Istituto Oncologico Romagnolo-Meldola, Dr. Luca Frassinetti
- Ospedale Humanitas, Milano Dr.ssa Lorenza Rimassa
- Ospedale Niguarda-Milano, Dr.ssa Katia Bencardino
- Istituto Oncologico Veneto-Padova, Dr.ssa Sara Lonardi
- Università di Pisa, Dr. Enrico Vasile
- Policlinico Gemelli-Roma, Dr. Giampaolo Tortora
- Mauriziano-Torino, Dr. Alessandro Ferrero
- Ospedale di Verona, Dr Michele Milella
- Ospedale di Vicenza, Dr. Giuseppe Aprile*
- Ospedale di Aviano, Dr.ssa Angela Buonadonna*
- Istituto Oncologico di Bari, Dr. Nicola Silvestris*
- Poliambulanza di Brescia, Dr. Alberto Zaniboni*
- Policlinico di Monserrato-Cagliari, Dr. Mario Scartozzi*
- Ospedale di Macerata, Dr. Nicola Battelli*
- Ospedale di Napoli Federico II, Dr. Roberto Bianco*
- Ospedale Civico di Palermo, Dr Livio Blasi*
- Ospedale di Treviso, Dr. Marco Massani
- Ospedale di Udine, Dr.ssa Nicoletta Pella*
* solo oncologia
Supporta anche tu PACT-21, dona ora con bonifico bancario o con Paypal.