Questo post è la traduzione di un interessante articolo sul tema degli approcci degli oncologi alla cura dei tumori apparso sul New York Times Magazine:
The Improvisational Oncologist
di Siddhartha Mukherjee.
Mukherjee è probabilmente uno degli oncologi più famosi al mondo e uno scienziato della Columbia University. Nel 2011 ha vinto il Premio Pulitzer per la narrativa per il suo libro “L’imperatore del male. Una biografia del cancro”. Il suo nuovo libro “Il gene. Il viaggio dell’uomo al centro della vita“ è stato ancora una volta un grande successo editoriale.
Bisogna comunque tenere il contesto americano dei contenuti dell’articolo. In Italia per ragioni legislative, organizzative degli ospedali e per disponibilità di fondi alcune pratiche descritte non sono materialmente possibili. Ciò nondimeno l’articolo offre importanti spunti di riflessione.
Marzo 2016
In un’epoca di rapida proliferazione di trattamenti personalizzati, ogni caso di tumore deve essere gestito come una musica suonata ad orecchio.
La biopsia del midollo osseo era durata circa 20 minuti. Erano le 10 di una mattinata insolitamente fredda a New York di Aprile, e Donna M., una donna di 78 anni, molto padrona di sé, aveva volato da Chicago per incontrarmi nel mio studio presso il Columbia University Medical Center. La sera prima si era concessa un concerto d’orchestra, “Gli Umani”, ed ora era in attesa nella stanza in una condizione in cui a nessuno dovrebbe essere mai chiesto di aspettare: pantaloni giù, schiena curva, ginocchia sollevate al petto – una donna matura accovacciata in posizione fetale. Ho messo su i guanti sterili mentre l’infermiera ha tirato fuori un carrello contenente un ago in acciaio della lunghezza del dito indice. Il bordo dell’osso pelvico di Donna era stato anestitizzato e ho guidato l’ago, nel modo più dolce possibile, nell’estremità esterna dell’osso. Il dolore è venuto fuori dal suo corpo come una sorta di cavatappi mentre il midollo veniva aspirato, insieme ad alcuni millilitri di materiali organici rossi, ossidati di ossa, che hanno riempito la siringa. Era leggermente viscoso, a metà tra il liquido e il gel, come la polpa schiacciata di una fragola molto matura.
Seguo Donna in collaborazione alla mia collega Azra Raza da sei anni. Donna ha una sindrome pre-leucemica chiamata sindrome mielodisplastica, o MDS, che colpisce il midollo osseo e il sangue. È una malattia misteriosa con poche cure note. Il midollo osseo umano è normalmente il posto dove nascono la maggior parte delle cellule del nostro sangue – una sorta nursery per il sangue giovane. Nelle MDS, le cellule del midollo osseo acquisiscono delle mutazioni genetiche che le costringono a crescere in modo incontrollabile – ma poi queste cellule giovani non riescono né a maturare né a diventare sangue, e inoltre muoiono a frotte. È una maledizione doppia. Nella maggior parte dei tumori, il problema principale sono le cellule che rifiutano di smettere di crescere. Nel midollo Donna, questo problema è aggravato da cellule che si rifiutano di crescere.
Anche se ci sono delle comunanze tra i tumori, ovviamente, ogni tumore si comporta e si muove – “pensa“, anche – in modo diverso. Cercando di trovare un farmaco che si adattasse al tumore di Donna, Raza e io le abbiamo somministrato una gamma di farmaci. Durante tutto questo tempo Donna è stata un paziente formidabile: perennemente ingegnosa, ottimista e disposta a provare qualunque cosa. (Ogni volta che la incontro in clinica mentre con grande forza d’animo è in attesa in della sua biopsia, è il medico, non il paziente, che si sente piccolo e in posizione fetale). Ha peregrinato da una sperimentazione clinica all’altra, spostandosi di città in città, e da un farmaco all’altro, attraverso un paesaggio più desolato di quanto molti di noi possono immaginare; Donna chiama il percorso di cura la sua “monogamia seriale” con i diversi medicinali. Alcuni di questi farmaci hanno funzionato per settimane, alcuni per mesi – ma le risposte transitorie hanno lasciato la strada ad inevitabili recidive. Donna comincia ad esaurire le sue energie.
La sua biopsia quella mattina era quindi parte di routine e parte di esperimenti. Pochi minuti dopo il prelievo del midollo, un tecnico ha subito portato il materiale prelevato in laboratorio. Lì hanno estratto le cellule dalla miscela e lo hanno pipettato in piccoli pezzi come chicchi di grano, 500 celle per ogni pezzo. A ciascun pezzo, circa 1.000 in totale, si aggiungerà un piccolo dosatore di un singolo farmaco: prednisone, ad esempio, a un pezzo, procarbazina al successivo e così via. L’esperimento sperimenta circa 300 farmaci (molti non sono stati addirittura destinati ai tumori) a tre diverse dosi per valutare gli effetti dei farmaci sulle cellule Donna.
Il materiale prelevato viene immerso in un sostanza ricca di nutrienti ricchi di fattori di crescita, le cellule si raddoppieranno in un incubatore nel corso delle due settimane successive, dando luogo ad un’enorme crescita di cellule maligne – sintesi di un cancro in una capsula. Un computer, addestrato a contare e valutare le cellule, determinerà se uno dei farmaci abbia ucciso le cellule cancerose o le ha costrette a maturare in sangue quasi normale. Lungi dal fare affidamento su dati provenienti da altri trial o pazienti, l’esperimento testerà il tumore di Donna per la sua reattività rispetto ad un gruppo di farmaci. Le cellule, non i corpi, sono entrati in questo studio preclinico e i risultati guideranno il suo futuro trattamento.
Ho spiegato tutto questo a Donna. Tuttavia lei ha fatto una domanda: che cosa succederà se il farmaco che sembrava essere il più promettente si rivelerà inefficace?
“Allora proveremo il prossimo,” le dissi. “L’esperimento, speriamo, porterà più di un candidato, e andremo in fondo alla lista”.
“La medicina sarà come la chemioterapia?”
“Potrebbe, o forse no. Il farmaco che alla fine utilizzeremo potrebbe essere preso in prestito da qualche altra malattia. Potrebbe essere una pillola antinfiammatoria o un farmaco per l’asma. Per quello che ne sappiamo potrebbe essere l’aspirina”
La mia conversazione con Donna rifletteva quanto il trattamento dei tumori sia cambiato nell’ultimo decennio. Sono cresciuto come oncologo in un’epoca di protocolli standardizzati. I tumori sono stati raggruppati in categorie basati sul loro sito di origine anatomico (cancro al seno, cancro del polmone, linfoma, leucemia) e il trattamento chemioterapico, spesso una combinazione di farmaci tossici, è stato dettato da quelle classificazioni anatomiche. Le combinazioni – Adriamicina, bleomicina, vinblastina e dacarbazina, ad esempio, per il trattamento della malattia di Hodgkin – sono state raramente modificate per singoli pazienti. La prospettiva di personalizzare la terapia era disapprovata: più ci si allontana dallo standard, la teoria dice, più il paziente avrebbe finito con alta probabilità adessere curato male o gestito in modo improprio, rischiando delle recidive. Negli ospedali e nelle cliniche sono stati istituiti sistemi informatici per monitorare la conformità di un oncologo rispetto alla terapia standard. Se si è scelto di fare un’eccezione per un particolare paziente, è necessario giustificare la scelta con un’adeguata motivazione. Big Chemo ti stava guardando.
Ho memorizzato i nomi abbreviati dellle combinazioni di farmaci chemioterapici – la prima lettera di ogni farmaco – per i miei esami e li ho ripresi e utilizzati con miei pazienti durante le mie ore di clinica. C’era qualcosa di magico e sciamanico in quegli acronimi. Erano delle sorta di mantra intrisi di promesse e di pericolo: A.B.V.D. per Hodgkin’s, C.M.F. per il tumore al seno, B.E.P. per il tumore testicolo. Il gergo dei chemioterapisti era come un codice segreto o una stretta di mano; anche la sola capacità di chiamare tali veleni per nome mi faceva sentire potente. Quando i miei pazienti mi chiedevano dati statistici avevo i numeri sulle punte delle mie dita. Potevo indicare con precisone la probabilità di sopravvivenza, la probabilità di recidiva, la probabilità che la chemio li rendesse sterili o gli causasse la perdita dei capelli. Mi sentivo onniscente.
Tuttavia, mentre parlavo con Donna quella mattina, ho capito come tutta questa onniscienza abbia cominciato a diminuire – innescando un approccio più sperimentale o quasi artigianale in oncologia. La maggior parte dei pazienti affetti da tumore è ancora trattata con quei protocolli standardizzati, governati dall’anatomia dell’organo del cancro. Ma per i pazienti come Donna, per i quali i soliti trattamenti non funzionano, gli oncologi devono utilizzare la loro conoscenza, spirito e creatività per inventare terapie individualizzate. Sempre più ci avviciniamo ad ogni paziente come un problema unico da risolvere. Farmaci tossici che agiscono in modo indiscriminato su tutte le cellule stanno lasciando il posto a molecole più agili che possono mirare un modo più preciso all’attivazione o disattivazione di pathways complessi nelle cellule, rimuovendo i fattori di crescita, accelerarando o decelerarando la risposta immunitaria o soffocando la fornitura di nutrienti e ossigeno alle cellule tumorali. Sempre più dobbiamo trovare modi per usare i farmaci come strumenti di precisione per inceppare e spegnere interruttori selettivi in particolari cellule tumorali. Gli oncologi formati per seguire le regole sono ora invitati a rinventarle.
Il pensiero che ogni singolo tumore potrebbe richiedere un trattamento specifico individualizzato può essere profondamente inquietante. Michael Lerner, uno scrittore che ha lavorato con i pazienti affetti da tumore, una volta ha paragonato l’esperienza di una diagnosi di tumore essere a quella di un lancio da un paracadute senza una mappa o una bussola; ora è l’oncologo che si sente paracadutato su uno strano paesaggio, senza alcuna idea di quale sia la strada da percorrere. Spesso non esistono dati statistici di esperienze precedenti, e ancor meno certezze. L’asticella del successo è diventata più alta, i successi più sorprendenti e i fallimenti più personali. In precedenza si stendevano veli di colpa intorno a un paziente. Quando non rispondeva alla chemioterapia, colpa era sua: lei aveva fallito. Ora, se non riesco a trovare uno strumento nel crescente insieme di farmaci a disposizione per colpire le vulnerabilità del cancro, allora la sensazione è che il trend si è invertito: è il medico che ha fallito.
Eppure, l’attuale epoca senza mappe precise di navigazione del tumore può avere un più grande potenziale per i pazienti rispetto a tutte le situazioni precedenti – anche se siamo nella situazione in cui il mondo che conosciamo si sposta sotto i nostri piedi. Non dobbiamo più trattare il cancro solo con la risposta spuntata dei protocolli standard, in cui la malattia è immaginata come un avversario uniforme, senza un volto. Invece dovremmo cercare di valutare la particolare personalità e il temperamento di una malattia individuale, in modo da poter adattare una risposta con estrema precisione. È la mente detestabile di ogni tumore che stiamo cercando disperatamente di comprendere.
Il tumore e le sue cure un tempo ci sembravano più semplici. Nel dicembre del 1969, un gruppo di sostenitori delle cure del cancro guidato dalla filantropa Mary Lasker ha pubblicizzato con grande enfasi la richiesta di una guerra nazionale contro il cancro in un annuncio a pagina intera sul The New York Times: “Mr. Nixon: tu puoi curare il cancro “. Ciò ha simboleggiato l’idea di una sola soluzione ad una singola malattia monumentale. Per un po’ l’idea portante di questa approccio è stata considerata la sequenza: intervento chirurgico, radiazioni e chemioterapia; una strategia colloquialmente nota come “taglia e brucia”. Utilizzando combinazioni di farmaci chemioterapici uomini e donne sono stati trascinati fino all’orlo della tollerabilità fisiologica, ma poi riacciuffati giusto in tempo in tempo per spedire il tumore, e non il suo ospite, fuori careggiata.
Durante gli anni ’80 e ’90 decine di migliaia di pazienti hanno partecipato a sperimentazioni cliniche che hanno messo a confronto i risultati di pazienti a cui era stata somministrata la combinazione standard di chemioterapia con quelli di altri pazienti a cui erano state somministrate combinazioni leggermente differenti degli stessi farmaci. Alcuni hanno risposto bene, ma per molti altri, le recidive sono state una routine – e i miglioramenti per la maggior parte dei tumori sono stati piccoli e incrementali. Sono stati fatti pochi sforzi per differenziare i pazienti; invece, quando le cure promesse per le malattie più avanzate non sono arrivate, si è pensato di aumentare le dosi dei farmaci a disposizione. Nella commedia Wit di Margaret Edson, una professoressa di inglese che aveva un tumore ovarico, il linguaggio incomprensibile di questi studi è stato rinterpretato inventando nomi assurdi per i farmaci chemioterapici che le erano stati pompati nel suo corpo: “Sono sopravvissuta a otto trattamenti di esametofosfacil e vinlatino alla dose massima, signore e signori. Ho stabilito un nuovo record “.
Ad essere sinceri, abbiamo imparato lezioni importanti dagli studi clinici. Utilizzando combinazioni di farmaci chemioterapici abbiamo imparato a trattare tumori particolari: linfomi aggressivi e alcune varianti di tumori al seno, testicolo e colon. Ma per la maggior parte degli uomini e delle donne con un tumore, i risultati clinici sono stati delle grandi delusioni. Nessun record è stato infranto o abbattuto – ma i pazienti lo erano.
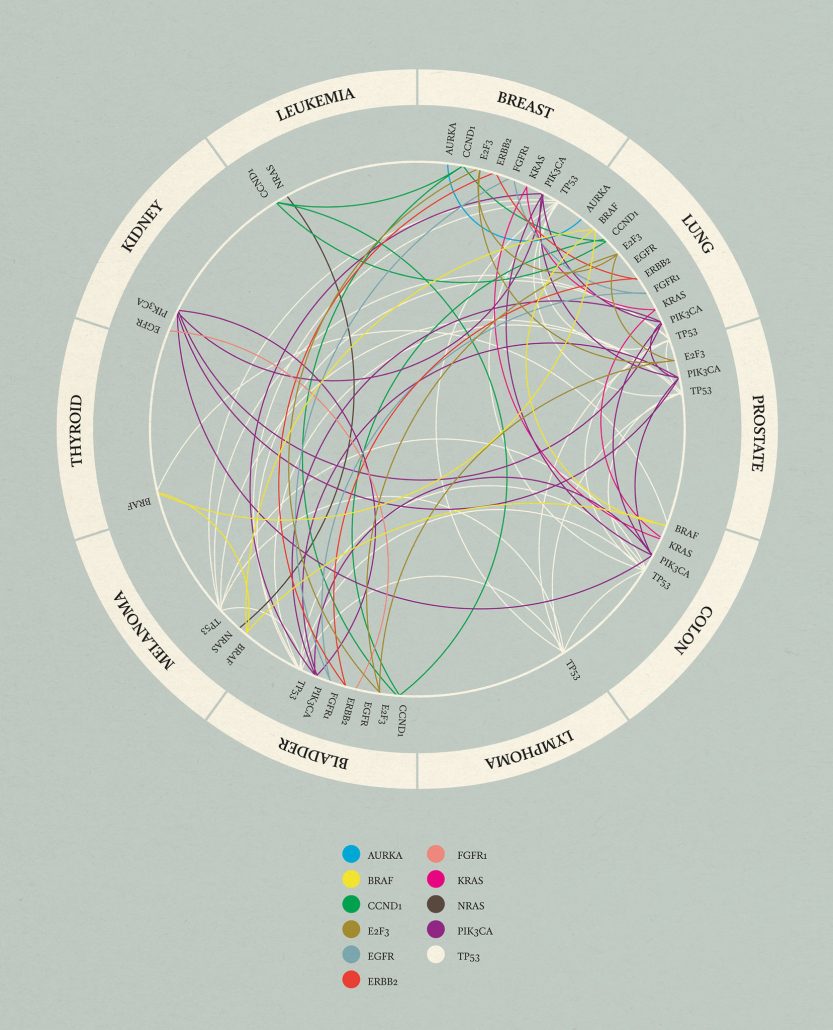
Una svolta è avvenuta negli anni 2000, poco dopo il progetto del genoma umano, quando gli scienziati hanno imparato a sequenziare i genomi delle cellule tumorali. Il tumore è una malattia tipicamente genetica. I geni mutanti nelle cellule tumorali alterano la normale fisiologia della crescita e, infine, ne determinano una proliferazione maligna. Questa caratteristica si trova al centro di tutte le forme tumorali: a differenza delle normali cellule, le cellule tumorali hanno dimenticato come smettere di dividersi (o talvolta, hanno dimenticato come morire). Ma se anche potessimo sequenziare decine di migliaia di geni nei singoli campioni dei tumori, quello che emerge è l’unicità di ogni singolo tumore. Supponiamo che due tumori al seno dall’aspetto simile si manifestino nello stesso momento in due gemelle identiche; le mutazioni dei due tumori saranno le stesse stesse? È improbabile: sequenziando le mutazioni nel tumore al seno di una gemella, potremmo trovare, diciamo, 74 geni mutati (di circa 22.000 geni totali nell’uomo). Nell’altra gemella potremmo trovare 42 mutazioni e se guardassimo una terza donna non correlata alle die gemelle con il tumore al seno, potremmo trovarne 18. Tra i tre casi, ci potrebbero esserci solo cinque geni che si sovrappongono. Il resto sono mutazioni particolari per il tumore di ogni donna.
Nessuna altra malattia umana conosciuta possiede questo grado di eterogeneità genetica. Il diabete in età adulta, ad esempio, è una malattia genetica complessa, ma sembra essere dominata da variazioni di una sola dozzina di geni. Il tumore invece ha variazioni potenzialmente illimitate. Come i volti, come le impronte digitali – come noi stessi – ogni tumore è caratterizzato dai suoi segni distintivi: un insieme di singole cicatrici stampate su un genoma individuale. La malattia iconica del XX secolo sembra riflettere l’ossessione della nostra cultura per l’individualità.
Se ogni singolo tumore ha una singola combinazione di mutazioni dei geni forse questa variabilità spiega le divergenze straordinarie nelle risposte al trattamento. Il sequenziamento ci permette di identificare i cambiamenti genetici che sono peculiari per un dato tumore. Potremmo utilizzare queste informazioni per guidare la cura del tumore – titolare il trattamento giusto per il tumore del singolo paziente.
Molti degli importanti successi nella cura dei tumori degli ultimi decenni sono esempi di farmaci che sono stati abbinati alle particolari vulnerabilità di singoli tumori. Il farmaco Gleevec, per esempio, può uccidere le cellule di leucemia – ma solo se le cellule tumorali del paziente portano la mutazione del gene chiamata BCR-ABL. Tarceva, una terapia specifica del tumore ai polmoni, funziona in maniera efficace se le cellule tumorali del paziente hanno una particolare mutazione genetica; per i pazienti affetti sempre affetti dal tumore del polmone privi di tale mutazione assumere tale farmaco è equivalente ad un placebo. Poiché questi medicinali mirano a mutazioni o comportamenti specifici per le cellule tumorali (ma non le cellule normali), molti di questi farmaci hanno tossicità sorprendentemente minime – molto più basse rispetto alle combinazioni chemioterapiche del passato.
Qualche giorno dopo la visita di Donna alla clinica, sono andato alla mia riunione settimanale con Raza al nono piano dell’ospedale. La paziente quella mattina era K.C., una donna di 79 anni con un tumore al al sangue. Raza stava seguendo la sua malattia – mantenendola in vita – da un decennio.
“Il suo tumore sta evolvendo in una leucemia acuta” disse Raza. Anche questo è un comportamento distintivo di alcuni tumori che oggi possiamo verificare usando biopsie, scansioni CT e nuove tecniche potenti come il sequenziamento dei geni: possiamo vedere i tumori che modificano mutazioni non pericolose in tipologie più aggressive davanti ai nostri occhi.
“Il tumore è stato sequenziato ?” chiesi.
“Sì, abbiamo la sequenza”, disse Raza, mentre ci accostavamo verso uno schermo per esaminarlo. Dall’elenco dei geni mutati lesse: “P53, DNMT3a e Tet2”. “E una delezione nel Cromosoma 5.” Nel caso del tumore di K.C. un intero segmento del genoma era stato eliminato e scomparso – una delle mutazioni più pericolose che un tumore possa generare.
“Cosa ne pensi dell’ATRA?” chiesi. Avevamo trattato alcuni pazienti che portavano alcune delle mutazioni di K.C. con questo farmaco e avevamo notato alcune importanti risposte .
“No. Preferirei piuttosto provare il Revlimid, ma con una dose più elevata. Lei ha già risposto bene in passato a questo farmaco e le mutazioni rimangono le stesse. Ho la sensazione che possa funzionare”
Mentre Raza e io ritornavamo nella stanza di C.C. per informarla del piano, non potevo fare a meno di pensare alle conclusioni a cui eravamo arrivati: piccole evidenze, osservazioni, istinto. Una medicina basata su premonizioni. Chemioterapia da sensazioni. La discussione sarebbe potuta sembrare molto particolare o artefatta ad un estraneo, ma non c’era nulla di supponente. Abbiamo analizzato queste possibilità con la massima serietà. Abbiamo studiato le sequenze, considerato le risposte passate, la recente storia del paziente – e poi le abbiamo portate avanti sulla base delle nostre migliori ipotesi. Le nostre decisioni sono motivate dalla scienza, sì, ma anche da un certo senso per l’arte della medicina.
Gli oncologi praticano questa arte anche in settori che fanno meno affidamento sui geni e mutazioni. Una settimana dopo la biopsia di Donna, sono andato a trovare Owen O’Connor, un oncologo che dirige il centro dei linfomi della Columbia. O’Connor, un oncologo sulla cinquantina, mi ricorda un veicolo anfibio a terra, in grado di navigare su ogni terreno. Ci siamo seduti nel suo ufficio, con ampie vetrate luminose con vista sulla Rockefeller Plaza. Per decenni, mi ha spiegato, gli oncologi hanno trattato il linfoma di Hodgkin con procedure standard. “C’erano opzioni limitate”, ha detto O’Connor. “Abbiamo dato alcuni pazienti più chemioterapia, in alcuni casi con con dosi più elevate e farmaci più tossici, sperando in una risposta. Per alcuni abbiamo cercato di curare la malattia usando il trapianto di midollo osseo. “Ma il tasso di fallimento era elevato: circa il 30 per cento dei pazienti non ha risposto e la metà di loro è morta.
Poi un anno fa ha provato qualcosa di nuovo. Ha cominciato ad usare la terapia immunologica per il trattamento dei casi di recidiva, il linfoma Hodgkin refrattario. Le terapie immunologiche sono disponibili in varie forme. Ci sono gli anticorpi: proteine simili a missili, derivate dai nostri sistemi immunitari, che sono progettati per attaccare e distruggere i microbi stranieri (gli anticorpi possono anche essere prodotti artificialmente attraverso l’ingegneria genetica, muniti con tossine e utilizzati come “farmaci” per uccidere le cellule tumorali) . E ci sono farmaci che inducono il sistema immunitario del paziente a riconoscere e uccidere le cellule tumorali, un modalità di cura ripresa dopo decenni di scarsa considerazione. O’Connor ha usato entrambe le terapie e ha scoperto che hanno funzionato in pazienti con malattia di Hodgkin. “Abbiamo cominciato a vedere risposte spettacolari” ha detto.
Eppure, anche se molti uomini e donne con recidive del linfoma Hodgkin hanno risposto ai trattamenti immunologici, ce ne erano alcuni che rimanevano profondamente resistenti. “Questi pazienti sono i più difficili da trattare” continuò O’Connor. “I loro tumori sembravano essere unici – una categoria a parte”.
Lorenzo Falchi, un compagno di studi di O’Connor e mio, era stato incuriosito da questi pazienti resistenti alle cure. Falchi è arrivato nel nostro ospedale dall’Italia, dove si è specializzato nel trattamento delle leucemie e dei linfomi; la sua particolare abilità, consolidata attraverso la sua esperienza con migliaia di pazienti, è quella della ricerca di strutture di dati ricorrenti apparentemente casuali in grosse moli di dati. Cercando nei database medici della Columbia Falchi ha fatto una scoperta sorprendente: gli uomini e le donne che hanno risposto meglio alle terapie, che aumentano la capacità di reazione del sistema immunitario, sono state sempre trattate prima con un altro farmaco chiamato azacitidina, usato raramente nei pazienti con linfoma. Una donna di 35 anni di New York con linfoma recidivo ha visto i suoi grossi noduli scomparire. Aveva ricevuto l’azacitidina come parte di un altro studio prima di passare all’immunoterapia. Un uomo, con uno stadio di tumore simile, non era stato pretrattato. Ebbe solo una risposta parziale, e la sua malattia tornò a manifestrasi subito dopo.
Falchi e O’Connor hanno deciso di utilizzare questa piccola “procedura di allenamento” per iniziare uno studio clinico in miniatura di pazienti con malattia recidiva di Hodgkin. “La proveremo solo su due o tre pazienti” mi disse Falchi. “Prima utilizzeremo l’azacitidina – intenzionalmente questa volta – e poi colpiremo il tumore con gli attivatori immunitari. Sospetto che ritroveremo le risposte che abbiamo visto nei nostri studi retrospettivi. “Anche nel tumore come cellule del polmone i medici hanno osservato che lil pretrattamento dei pazienti con azacitidina può renderli più reattivi alla terapia immunologica. Falchi e O’Connor stanno cercando di capire perché i pazienti rispondono se sono pretrattati con un farmaco che sembra, sulla base delle sue cartteristiche, non avere nulla a che fare con il sistema immunitario. Forse l’azacitidina rende le cellule tumorali più riconoscibili estranee, o forse forza le cellule immunitarie a diventare dei cacciatori più aggressivi.
Supponiamo che ogni cancro sia davvero unico, con una propria permutazione di geni e vulnerabilità – una sola “odiosa” mente. Ovviamente è assurdo immaginare che troveremo una singola medicina per trattare ciascuno di essi: ci sono 14 milioni di nuovi casi di cancro al mondo ogni anno, e diversi milioni di pazienti si presenteranno con malattie avanzate che richiedono più di un trattamento locale o chirurgico. Cercare di individualizzare il trattamento per quei casi frantumerebbe qualsiasi tetto di costo.
Ma mentre i costi medici delle terapie personalizzate vengono discussi nei forum nazionali a Washington, i pazienti nella mia modesta sala d’attesa di New York si concentrano sui loro costi personali. L’assicurazione non paga per gli usi “non-etichettati” dei medicinali: non è facile convincere un’azienda di assicurazioni che si intende utilizzare il Lipitor per curare una donna con pre-leucemia – non perché ha un alto livello di colesterolo, ma perché le cellule tumorali dipendono dal metabolismo del colesterolo per la loro crescita (in uno studio di un sottotipo di leucemia, le cellule in aumento erano fortemente dipendenti dal colesterolo, suggerendo che dosi elevate di farmaci simili a Lipitor potrebbero essere un trattamento efficace).
In casi eccezionali, i medici possono richiedere alle aziende farmaceutiche di fornire gratuitamente i farmaci – per “uso compassionevole”, per utilizzare il linguaggio del mondo farmaceutico, ma questo processo è imprevedibile e richiede tempo. In passato compilavo tali richieste una volta ogni pochi mesi. Ora mi sembra di richiedere tali eccezioni su base settimanale. Alcune sono approvate. La maggioranza, purtroppo, non viene autorizzata.
Così i medici come Falchi e O’Connor fanno quello che possono – devono usare la loro astuzia non solo contro il cancro, ma anche contro un sistema che resiste all’innovazione. Progettano e realizzano piccole sperimentazioni cliniche originali che coinvolgono solo 10 o 20 pazienti, situazioni molto lontane dalle prove centomila pazienti degli anni ’80 e ’90. Essi studiano questi pazienti con dedizione monastica, tirando fuori un’immensità di dati preziosi da quei piccoli gruppi. Di tanto in tanto, un paziente può scegliere di pagare i farmaci dalle proprie tasche – ma è raro che un paziente possa pagarsi le decine di migliaia di dollari del costo dei farmaci.
Ma non ci potrebbe essere che un numero minimo di cure che potrebbero essere utilizzate per trattare la maggioranza di questi tumori in modo efficace e meno costoso? Forse Bert Vogelstein, un genetista dei tumori all’università Johns Hopkins, è lo scienziato di qualsiasi altro, ha affrontato questo complicato problema. Vogelstein afferma che la combinazione di mutazioni genetiche in ogni singolo cancro è unica. Ma queste mutazioni genetiche possono ancora agire attraverso delle vie metaboliche o pathways
[Ndr: La via metabolica (spesso chiamata pathway metabolico o più semplicemente pathway) è l’insieme delle reazioni chimiche coinvolte in uno o più processi di anabolismo o catabolismo all’interno di una cellula] .Bersagliando queste vie metaboliche, piuttosto che i singoli geni, potremmo riorganizzare e ripensare il nostro modo di percepire e curare i tumori.
Immaginate di nuovo una cellula come una macchina complessa, con migliaia di ruote, leve e pulegge organizzate in sistemi. Questo macchina nel caso delle cellule cancerogene non funziona bene: alcune leve e pulegge sono bloccate o rovinate, e come risultato si ha che una cellulla cancerogena continua a dividersi e riprodursi senza controllo. Se ci concentriamo sulle singole parti che sono inceppate e bloccate, scopriamo che le permutazioni, ovvero il numero di combinazioni possibili interazioni tra le varie parti rotte, è apparentemente infinito: ogni istanza di una singola macchina rotta sembra avere un’impronta digitale distinta di ingranaggi rotti. Ma se invece di concentrarci sui singoli componenti che non funzionano ci concentriamo invece sui sistemi che non funzionano, allora dall’apparente altissima diversità cominciano a emergere delle strutture ricorrenti, pattern. Ad esempio supponiamo che dieci componenti funzionano in un sistema interconnesso per impedire che la macchina sbandi. Se riusciamo a identificare le parti di questo sistema, il risultato finale è che se una delle dieci parti non funziona correttamente il risultato è lo stesso: la macchina che sbanda. Supponiamo che altri 20 componenti controllino il termostato interno della macchina. Se si rompe uno di questi 20 componenti il sistema si surriscalda. Il numero di componenti – 10 o 20 – è ingannevole nella sua complessità e può avere permutazioni infinite [ndr: le possibili combinazioni di tutte le interazioni di 10 elementi differenti è pari a 3.628.000 possibili combinazioni!] Ma visto in una prospettiva di più alto livello, solo due sistemi in questa macchina sono stati coinvolti: quello della stabilità e e quello temperatura.
Il tumore, afferma Vogelstein, si comporta in maniera analoga. La maggior parte dei geni mutati nel componenti funzionano anche in cicli e circuiti: i pathways, le vie metaboliche. Superficialmente, le permutazioni dei difetti genetici potrebbero essere senza limiti, ma pensati nei pathways, la complessità può essere organizzata in un numero più limitato o in un nucleo di difetti strutturali. Forse questi pathways sono come i film di Hollywood; a prima vista, sembra che ci sia una serie infinita di possibili trame – La Corsa all’oro della California , l’Upper West Side, … . Ma l’esame più approfondito delle trame dei film produce solo una manciata di archetipi, di strutture, di narrazioni: il ragazzo incontra la ragazza, lo straniero viene in città, il figlio cerca il padre, ….
Quanti di tali pathways o sistemi operano in un sottotipo di un tumore? Guardando un tumore, quello del pancreas, e mappando le variazioni nei geni mutati attraverso centinaia di casi, il team di Vogelstein ha proposto una risposta sconcertante e semplice: 12 pathway. (Un esempio di “pathway” coinvolge i geni che consentono alle cellule di invadere altri tessuti. Questi geni consentono normalmente alle cellule di migrare attraverso parti del corpo – ma nel tumore, la migrazione diventa distorta in un’invasione pericolosa, le metastasi.) Se potessimo trovare farmaci che possano essere indirizzati a queste 12 pathways primarie, potremmo essere in grado di attaccare la maggior parte dei tumori del pancreas, nonostante la loro genetica diversità. Ma questo significa inventare 12 modi potenziali per bloccare queste pathways primarie – una sfida creativa immensa per gli scienziati, considerando che non hanno ancora capito come attacare una o due al massimo di queste dodici pathways.
Le terapie immunologiche forniscono una seconda soluzione allo stallo derivante da questa diversità illimitata. Un vantaggio nell’attivare il proprio sistema immunitario contro il tumore è che le cellule immunologiche sono generalmente agnostiche, non conoscono le mutazioni che causano una particolare crescita del tumore. Il sistema immunitario è stato progettato per individuare le differenze nelle caratteristiche superficiali di una cellula malata o straniera, identificandola e uccidendola. Si preoccupa poco di geni, è come un missile balistico intercontinentale il quale non si preoccupa degli indirizzi e-mail, o delle preferenze dietetiche, della popolazione che è stata inviata per distruggere.
Qualche anno fa, mentre scrivevo la storia dei tumori, ho intervistato Emil Freireich. Freireich, collaborava con Emil Frei presso il National Cancer Institute negli anni ’60 e ’70. Insieme si sono lanciati nelll’idea di utilizzare simultaneamente più farmaci tossici per il trattamento del tumore – quello che oggi chiamiamo chemioterapia combinata. Loro hanno inventato uno dei primi protocolli standard – vincristina, Adriamicina, metotrexato e prednisone, conosciuto come VAMP – per il trattamento delle leucemie pediatriche. Il protocollo VAMP praticamente non aveva niente del trattamento prsonalizzato (anche se le dosi potevano essere ridotte se necessario). Infatti, i medici furono scoraggiati dal tentativo di provare formule alternative.
Tuttavia come Freireich ha ricordato, molto tempo prima che arrivassero all’idea di un protocollo, c’erano piccoli e coraggiosi esperimenti; prima delle sperimentazioni cliniche c’era solo il metodo della “prova e errore”, trial & error. VAMP è stato creato attraverso la determinazione, l’istinto e un salto nel buio. Vincent T. DeVita Jr., che ha lavorato con Freireich negli anni ’60, ha scritto un libro, “La morte del cancro”, con la figlia Elizabeth DeVita-Raeburn. Nel libro ha ricordato il periodo in cui i bambini leucemici durante la sperimentazione clinica di Freireich morivano di meningite batterica durante il trattamento. Le morti minacciavano l’intera sperimentazione: se Freireich non riusciva a tenere in vita i bambini durante la terapia, non ci sarebbe possibilità di remissione. Avevano un antibiotico che avrebbe potuto uccidere il microbo, ma questo farmaco non sarebbe riuscito a penetrare la barriera sangue-cervello. Così Freireich ha deciso di provare qualcosa che andava oltre i limiti della pratica standard. Ha ordinato a DeVita, suo giovane assistente medico, di iniettare il farmaco direttamente nelle corde spinali dei suoi pazienti. Era un esempio estremo di uso non conforme del farmaco: la medicina non era destinata ad essere utilizzata nel cavo spinale. DeVita scrive:
“La prima volta che Freireich mi ha detto di farlo, ho sollevato la fiala e gli ho mostrato l’etichetta, pensando che forse non aveva letto qualcosa. Gli dissi: “Qui è scritto: Non usare intratecalmente “. Freireich mi guardò e mi puntò il suo lungo dito ossuto in faccia: “Fallo’!”, sbraitò. Lo feci, anche se ero terrorizzato. Ma ha funzionato ogni volta “.
Quando chiesi a Freireich di quell’episodio e se cambierebbe il suo comportamento nell’ attuale quadro di riferimento della terapia del cancro, lui ha sottolineato con estrema cautela. “Noi non avremmo mai ottenuto nulla nel quadro di riferimento attuale”, ha detto. Il pioniere dei protocolli per una volta rimpiangeva i tempi in cui non c’erano dei protocolli.
La medicina necessita di standard, ovviamente, altrimenti ci si potrebbe addentrare in terreni pericolosi, compromettendo la sicurezza e l’affidabilità delle cure. Ma la medicina del tumore ha anche bisogno di una sana dose di Freireich: il desiderio di leggere tra le linee (guida), di rielaborare i confini esterni, di eseguire gli esperimenti che diventano gli standard del futuro. Nel mese di Gennaio 2016, il presidente Obama ha avviato un’enorme campagna per la medicina di precisione. Il tumore è il suo bersaglio principale: utilizzando enormi moli di dati, tra cui sequenze di centinaia di migliaia di campioni e sperimentazioni eseguite nei laboratori a livello nazionale, l’obiettivo del progetto è quello di trovare farmaci personalizzati per il tumore di ogni paziente. Ma mentre si aspettano i risultati di questo progetto decennale, gli oncologi devono ancora trattare i pazienti nel presente. Per comprendere il comportamento dei singoli tumori, stiamo imparando a mescolare e adattare questi due tipi di apprendimento – lo standard e l’idiosincratico – in modi insoliti e creativi. È il tipo di medicina che volevamo imparare e per cui siamo andati nelle università di medicina, il tipo di medicina che abbiamo quasi dimenticato di praticare.
Condividi questo articolo

Questo post è la traduzione di un interessante articolo sul tema degli approcci degli oncologi alla cura dei tumori apparso sul New York Times Magazine:
The Improvisational Oncologist
di Siddhartha Mukherjee.
Mukherjee è probabilmente uno degli oncologi più famosi al mondo e uno scienziato della Columbia University. Nel 2011 ha vinto il Premio Pulitzer per la narrativa per il suo libro “L’imperatore del male. Una biografia del cancro”. Il suo nuovo libro “Il gene. Il viaggio dell’uomo al centro della vita“ è stato ancora una volta un grande successo editoriale.
Bisogna comunque tenere il contesto americano dei contenuti dell’articolo. In Italia per ragioni legislative, organizzative degli ospedali e per disponibilità di fondi alcune pratiche descritte non sono materialmente possibili. Ciò nondimeno l’articolo offre importanti spunti di riflessione.
Marzo 2016
In un’epoca di rapida proliferazione di trattamenti personalizzati, ogni caso di tumore deve essere gestito come una musica suonata ad orecchio.
La biopsia del midollo osseo era durata circa 20 minuti. Erano le 10 di una mattinata insolitamente fredda a New York di Aprile, e Donna M., una donna di 78 anni, molto padrona di sé, aveva volato da Chicago per incontrarmi nel mio studio presso il Columbia University Medical Center. La sera prima si era concessa un concerto d’orchestra, “Gli Umani”, ed ora era in attesa nella stanza in una condizione in cui a nessuno dovrebbe essere mai chiesto di aspettare: pantaloni giù, schiena curva, ginocchia sollevate al petto – una donna matura accovacciata in posizione fetale. Ho messo su i guanti sterili mentre l’infermiera ha tirato fuori un carrello contenente un ago in acciaio della lunghezza del dito indice. Il bordo dell’osso pelvico di Donna era stato anestitizzato e ho guidato l’ago, nel modo più dolce possibile, nell’estremità esterna dell’osso. Il dolore è venuto fuori dal suo corpo come una sorta di cavatappi mentre il midollo veniva aspirato, insieme ad alcuni millilitri di materiali organici rossi, ossidati di ossa, che hanno riempito la siringa. Era leggermente viscoso, a metà tra il liquido e il gel, come la polpa schiacciata di una fragola molto matura.
Seguo Donna in collaborazione alla mia collega Azra Raza da sei anni. Donna ha una sindrome pre-leucemica chiamata sindrome mielodisplastica, o MDS, che colpisce il midollo osseo e il sangue. È una malattia misteriosa con poche cure note. Il midollo osseo umano è normalmente il posto dove nascono la maggior parte delle cellule del nostro sangue – una sorta nursery per il sangue giovane. Nelle MDS, le cellule del midollo osseo acquisiscono delle mutazioni genetiche che le costringono a crescere in modo incontrollabile – ma poi queste cellule giovani non riescono né a maturare né a diventare sangue, e inoltre muoiono a frotte. È una maledizione doppia. Nella maggior parte dei tumori, il problema principale sono le cellule che rifiutano di smettere di crescere. Nel midollo Donna, questo problema è aggravato da cellule che si rifiutano di crescere.
Anche se ci sono delle comunanze tra i tumori, ovviamente, ogni tumore si comporta e si muove – “pensa“, anche – in modo diverso. Cercando di trovare un farmaco che si adattasse al tumore di Donna, Raza e io le abbiamo somministrato una gamma di farmaci. Durante tutto questo tempo Donna è stata un paziente formidabile: perennemente ingegnosa, ottimista e disposta a provare qualunque cosa. (Ogni volta che la incontro in clinica mentre con grande forza d’animo è in attesa in della sua biopsia, è il medico, non il paziente, che si sente piccolo e in posizione fetale). Ha peregrinato da una sperimentazione clinica all’altra, spostandosi di città in città, e da un farmaco all’altro, attraverso un paesaggio più desolato di quanto molti di noi possono immaginare; Donna chiama il percorso di cura la sua “monogamia seriale” con i diversi medicinali. Alcuni di questi farmaci hanno funzionato per settimane, alcuni per mesi – ma le risposte transitorie hanno lasciato la strada ad inevitabili recidive. Donna comincia ad esaurire le sue energie.
La sua biopsia quella mattina era quindi parte di routine e parte di esperimenti. Pochi minuti dopo il prelievo del midollo, un tecnico ha subito portato il materiale prelevato in laboratorio. Lì hanno estratto le cellule dalla miscela e lo hanno pipettato in piccoli pezzi come chicchi di grano, 500 celle per ogni pezzo. A ciascun pezzo, circa 1.000 in totale, si aggiungerà un piccolo dosatore di un singolo farmaco: prednisone, ad esempio, a un pezzo, procarbazina al successivo e così via. L’esperimento sperimenta circa 300 farmaci (molti non sono stati addirittura destinati ai tumori) a tre diverse dosi per valutare gli effetti dei farmaci sulle cellule Donna.
Il materiale prelevato viene immerso in un sostanza ricca di nutrienti ricchi di fattori di crescita, le cellule si raddoppieranno in un incubatore nel corso delle due settimane successive, dando luogo ad un’enorme crescita di cellule maligne – sintesi di un cancro in una capsula. Un computer, addestrato a contare e valutare le cellule, determinerà se uno dei farmaci abbia ucciso le cellule cancerose o le ha costrette a maturare in sangue quasi normale. Lungi dal fare affidamento su dati provenienti da altri trial o pazienti, l’esperimento testerà il tumore di Donna per la sua reattività rispetto ad un gruppo di farmaci. Le cellule, non i corpi, sono entrati in questo studio preclinico e i risultati guideranno il suo futuro trattamento.
Ho spiegato tutto questo a Donna. Tuttavia lei ha fatto una domanda: che cosa succederà se il farmaco che sembrava essere il più promettente si rivelerà inefficace?
“Allora proveremo il prossimo,” le dissi. “L’esperimento, speriamo, porterà più di un candidato, e andremo in fondo alla lista”.
“La medicina sarà come la chemioterapia?”
“Potrebbe, o forse no. Il farmaco che alla fine utilizzeremo potrebbe essere preso in prestito da qualche altra malattia. Potrebbe essere una pillola antinfiammatoria o un farmaco per l’asma. Per quello che ne sappiamo potrebbe essere l’aspirina”
La mia conversazione con Donna rifletteva quanto il trattamento dei tumori sia cambiato nell’ultimo decennio. Sono cresciuto come oncologo in un’epoca di protocolli standardizzati. I tumori sono stati raggruppati in categorie basati sul loro sito di origine anatomico (cancro al seno, cancro del polmone, linfoma, leucemia) e il trattamento chemioterapico, spesso una combinazione di farmaci tossici, è stato dettato da quelle classificazioni anatomiche. Le combinazioni – Adriamicina, bleomicina, vinblastina e dacarbazina, ad esempio, per il trattamento della malattia di Hodgkin – sono state raramente modificate per singoli pazienti. La prospettiva di personalizzare la terapia era disapprovata: più ci si allontana dallo standard, la teoria dice, più il paziente avrebbe finito con alta probabilità adessere curato male o gestito in modo improprio, rischiando delle recidive. Negli ospedali e nelle cliniche sono stati istituiti sistemi informatici per monitorare la conformità di un oncologo rispetto alla terapia standard. Se si è scelto di fare un’eccezione per un particolare paziente, è necessario giustificare la scelta con un’adeguata motivazione. Big Chemo ti stava guardando.
Ho memorizzato i nomi abbreviati dellle combinazioni di farmaci chemioterapici – la prima lettera di ogni farmaco – per i miei esami e li ho ripresi e utilizzati con miei pazienti durante le mie ore di clinica. C’era qualcosa di magico e sciamanico in quegli acronimi. Erano delle sorta di mantra intrisi di promesse e di pericolo: A.B.V.D. per Hodgkin’s, C.M.F. per il tumore al seno, B.E.P. per il tumore testicolo. Il gergo dei chemioterapisti era come un codice segreto o una stretta di mano; anche la sola capacità di chiamare tali veleni per nome mi faceva sentire potente. Quando i miei pazienti mi chiedevano dati statistici avevo i numeri sulle punte delle mie dita. Potevo indicare con precisone la probabilità di sopravvivenza, la probabilità di recidiva, la probabilità che la chemio li rendesse sterili o gli causasse la perdita dei capelli. Mi sentivo onniscente.
Tuttavia, mentre parlavo con Donna quella mattina, ho capito come tutta questa onniscienza abbia cominciato a diminuire – innescando un approccio più sperimentale o quasi artigianale in oncologia. La maggior parte dei pazienti affetti da tumore è ancora trattata con quei protocolli standardizzati, governati dall’anatomia dell’organo del cancro. Ma per i pazienti come Donna, per i quali i soliti trattamenti non funzionano, gli oncologi devono utilizzare la loro conoscenza, spirito e creatività per inventare terapie individualizzate. Sempre più ci avviciniamo ad ogni paziente come un problema unico da risolvere. Farmaci tossici che agiscono in modo indiscriminato su tutte le cellule stanno lasciando il posto a molecole più agili che possono mirare un modo più preciso all’attivazione o disattivazione di pathways complessi nelle cellule, rimuovendo i fattori di crescita, accelerarando o decelerarando la risposta immunitaria o soffocando la fornitura di nutrienti e ossigeno alle cellule tumorali. Sempre più dobbiamo trovare modi per usare i farmaci come strumenti di precisione per inceppare e spegnere interruttori selettivi in particolari cellule tumorali. Gli oncologi formati per seguire le regole sono ora invitati a rinventarle.
Il pensiero che ogni singolo tumore potrebbe richiedere un trattamento specifico individualizzato può essere profondamente inquietante. Michael Lerner, uno scrittore che ha lavorato con i pazienti affetti da tumore, una volta ha paragonato l’esperienza di una diagnosi di tumore essere a quella di un lancio da un paracadute senza una mappa o una bussola; ora è l’oncologo che si sente paracadutato su uno strano paesaggio, senza alcuna idea di quale sia la strada da percorrere. Spesso non esistono dati statistici di esperienze precedenti, e ancor meno certezze. L’asticella del successo è diventata più alta, i successi più sorprendenti e i fallimenti più personali. In precedenza si stendevano veli di colpa intorno a un paziente. Quando non rispondeva alla chemioterapia, colpa era sua: lei aveva fallito. Ora, se non riesco a trovare uno strumento nel crescente insieme di farmaci a disposizione per colpire le vulnerabilità del cancro, allora la sensazione è che il trend si è invertito: è il medico che ha fallito.
Eppure, l’attuale epoca senza mappe precise di navigazione del tumore può avere un più grande potenziale per i pazienti rispetto a tutte le situazioni precedenti – anche se siamo nella situazione in cui il mondo che conosciamo si sposta sotto i nostri piedi. Non dobbiamo più trattare il cancro solo con la risposta spuntata dei protocolli standard, in cui la malattia è immaginata come un avversario uniforme, senza un volto. Invece dovremmo cercare di valutare la particolare personalità e il temperamento di una malattia individuale, in modo da poter adattare una risposta con estrema precisione. È la mente detestabile di ogni tumore che stiamo cercando disperatamente di comprendere.
Il tumore e le sue cure un tempo ci sembravano più semplici. Nel dicembre del 1969, un gruppo di sostenitori delle cure del cancro guidato dalla filantropa Mary Lasker ha pubblicizzato con grande enfasi la richiesta di una guerra nazionale contro il cancro in un annuncio a pagina intera sul The New York Times: “Mr. Nixon: tu puoi curare il cancro “. Ciò ha simboleggiato l’idea di una sola soluzione ad una singola malattia monumentale. Per un po’ l’idea portante di questa approccio è stata considerata la sequenza: intervento chirurgico, radiazioni e chemioterapia; una strategia colloquialmente nota come “taglia e brucia”. Utilizzando combinazioni di farmaci chemioterapici uomini e donne sono stati trascinati fino all’orlo della tollerabilità fisiologica, ma poi riacciuffati giusto in tempo in tempo per spedire il tumore, e non il suo ospite, fuori careggiata.
Durante gli anni ’80 e ’90 decine di migliaia di pazienti hanno partecipato a sperimentazioni cliniche che hanno messo a confronto i risultati di pazienti a cui era stata somministrata la combinazione standard di chemioterapia con quelli di altri pazienti a cui erano state somministrate combinazioni leggermente differenti degli stessi farmaci. Alcuni hanno risposto bene, ma per molti altri, le recidive sono state una routine – e i miglioramenti per la maggior parte dei tumori sono stati piccoli e incrementali. Sono stati fatti pochi sforzi per differenziare i pazienti; invece, quando le cure promesse per le malattie più avanzate non sono arrivate, si è pensato di aumentare le dosi dei farmaci a disposizione. Nella commedia Wit di Margaret Edson, una professoressa di inglese che aveva un tumore ovarico, il linguaggio incomprensibile di questi studi è stato rinterpretato inventando nomi assurdi per i farmaci chemioterapici che le erano stati pompati nel suo corpo: “Sono sopravvissuta a otto trattamenti di esametofosfacil e vinlatino alla dose massima, signore e signori. Ho stabilito un nuovo record “.
Ad essere sinceri, abbiamo imparato lezioni importanti dagli studi clinici. Utilizzando combinazioni di farmaci chemioterapici abbiamo imparato a trattare tumori particolari: linfomi aggressivi e alcune varianti di tumori al seno, testicolo e colon. Ma per la maggior parte degli uomini e delle donne con un tumore, i risultati clinici sono stati delle grandi delusioni. Nessun record è stato infranto o abbattuto – ma i pazienti lo erano.
Una svolta è avvenuta negli anni 2000, poco dopo il progetto del genoma umano, quando gli scienziati hanno imparato a sequenziare i genomi delle cellule tumorali. Il tumore è una malattia tipicamente genetica. I geni mutanti nelle cellule tumorali alterano la normale fisiologia della crescita e, infine, ne determinano una proliferazione maligna. Questa caratteristica si trova al centro di tutte le forme tumorali: a differenza delle normali cellule, le cellule tumorali hanno dimenticato come smettere di dividersi (o talvolta, hanno dimenticato come morire). Ma se anche potessimo sequenziare decine di migliaia di geni nei singoli campioni dei tumori, quello che emerge è l’unicità di ogni singolo tumore. Supponiamo che due tumori al seno dall’aspetto simile si manifestino nello stesso momento in due gemelle identiche; le mutazioni dei due tumori saranno le stesse stesse? È improbabile: sequenziando le mutazioni nel tumore al seno di una gemella, potremmo trovare, diciamo, 74 geni mutati (di circa 22.000 geni totali nell’uomo). Nell’altra gemella potremmo trovare 42 mutazioni e se guardassimo una terza donna non correlata alle die gemelle con il tumore al seno, potremmo trovarne 18. Tra i tre casi, ci potrebbero esserci solo cinque geni che si sovrappongono. Il resto sono mutazioni particolari per il tumore di ogni donna.
Nessuna altra malattia umana conosciuta possiede questo grado di eterogeneità genetica. Il diabete in età adulta, ad esempio, è una malattia genetica complessa, ma sembra essere dominata da variazioni di una sola dozzina di geni. Il tumore invece ha variazioni potenzialmente illimitate. Come i volti, come le impronte digitali – come noi stessi – ogni tumore è caratterizzato dai suoi segni distintivi: un insieme di singole cicatrici stampate su un genoma individuale. La malattia iconica del XX secolo sembra riflettere l’ossessione della nostra cultura per l’individualità.
Se ogni singolo tumore ha una singola combinazione di mutazioni dei geni forse questa variabilità spiega le divergenze straordinarie nelle risposte al trattamento. Il sequenziamento ci permette di identificare i cambiamenti genetici che sono peculiari per un dato tumore. Potremmo utilizzare queste informazioni per guidare la cura del tumore – titolare il trattamento giusto per il tumore del singolo paziente.
Molti degli importanti successi nella cura dei tumori degli ultimi decenni sono esempi di farmaci che sono stati abbinati alle particolari vulnerabilità di singoli tumori. Il farmaco Gleevec, per esempio, può uccidere le cellule di leucemia – ma solo se le cellule tumorali del paziente portano la mutazione del gene chiamata BCR-ABL. Tarceva, una terapia specifica del tumore ai polmoni, funziona in maniera efficace se le cellule tumorali del paziente hanno una particolare mutazione genetica; per i pazienti affetti sempre affetti dal tumore del polmone privi di tale mutazione assumere tale farmaco è equivalente ad un placebo. Poiché questi medicinali mirano a mutazioni o comportamenti specifici per le cellule tumorali (ma non le cellule normali), molti di questi farmaci hanno tossicità sorprendentemente minime – molto più basse rispetto alle combinazioni chemioterapiche del passato.
Qualche giorno dopo la visita di Donna alla clinica, sono andato alla mia riunione settimanale con Raza al nono piano dell’ospedale. La paziente quella mattina era K.C., una donna di 79 anni con un tumore al al sangue. Raza stava seguendo la sua malattia – mantenendola in vita – da un decennio.
“Il suo tumore sta evolvendo in una leucemia acuta” disse Raza. Anche questo è un comportamento distintivo di alcuni tumori che oggi possiamo verificare usando biopsie, scansioni CT e nuove tecniche potenti come il sequenziamento dei geni: possiamo vedere i tumori che modificano mutazioni non pericolose in tipologie più aggressive davanti ai nostri occhi.
“Il tumore è stato sequenziato ?” chiesi.
“Sì, abbiamo la sequenza”, disse Raza, mentre ci accostavamo verso uno schermo per esaminarlo. Dall’elenco dei geni mutati lesse: “P53, DNMT3a e Tet2”. “E una delezione nel Cromosoma 5.” Nel caso del tumore di K.C. un intero segmento del genoma era stato eliminato e scomparso – una delle mutazioni più pericolose che un tumore possa generare.
“Cosa ne pensi dell’ATRA?” chiesi. Avevamo trattato alcuni pazienti che portavano alcune delle mutazioni di K.C. con questo farmaco e avevamo notato alcune importanti risposte .
“No. Preferirei piuttosto provare il Revlimid, ma con una dose più elevata. Lei ha già risposto bene in passato a questo farmaco e le mutazioni rimangono le stesse. Ho la sensazione che possa funzionare”
Mentre Raza e io ritornavamo nella stanza di C.C. per informarla del piano, non potevo fare a meno di pensare alle conclusioni a cui eravamo arrivati: piccole evidenze, osservazioni, istinto. Una medicina basata su premonizioni. Chemioterapia da sensazioni. La discussione sarebbe potuta sembrare molto particolare o artefatta ad un estraneo, ma non c’era nulla di supponente. Abbiamo analizzato queste possibilità con la massima serietà. Abbiamo studiato le sequenze, considerato le risposte passate, la recente storia del paziente – e poi le abbiamo portate avanti sulla base delle nostre migliori ipotesi. Le nostre decisioni sono motivate dalla scienza, sì, ma anche da un certo senso per l’arte della medicina.
Gli oncologi praticano questa arte anche in settori che fanno meno affidamento sui geni e mutazioni. Una settimana dopo la biopsia di Donna, sono andato a trovare Owen O’Connor, un oncologo che dirige il centro dei linfomi della Columbia. O’Connor, un oncologo sulla cinquantina, mi ricorda un veicolo anfibio a terra, in grado di navigare su ogni terreno. Ci siamo seduti nel suo ufficio, con ampie vetrate luminose con vista sulla Rockefeller Plaza. Per decenni, mi ha spiegato, gli oncologi hanno trattato il linfoma di Hodgkin con procedure standard. “C’erano opzioni limitate”, ha detto O’Connor. “Abbiamo dato alcuni pazienti più chemioterapia, in alcuni casi con con dosi più elevate e farmaci più tossici, sperando in una risposta. Per alcuni abbiamo cercato di curare la malattia usando il trapianto di midollo osseo. “Ma il tasso di fallimento era elevato: circa il 30 per cento dei pazienti non ha risposto e la metà di loro è morta.
Poi un anno fa ha provato qualcosa di nuovo. Ha cominciato ad usare la terapia immunologica per il trattamento dei casi di recidiva, il linfoma Hodgkin refrattario. Le terapie immunologiche sono disponibili in varie forme. Ci sono gli anticorpi: proteine simili a missili, derivate dai nostri sistemi immunitari, che sono progettati per attaccare e distruggere i microbi stranieri (gli anticorpi possono anche essere prodotti artificialmente attraverso l’ingegneria genetica, muniti con tossine e utilizzati come “farmaci” per uccidere le cellule tumorali) . E ci sono farmaci che inducono il sistema immunitario del paziente a riconoscere e uccidere le cellule tumorali, un modalità di cura ripresa dopo decenni di scarsa considerazione. O’Connor ha usato entrambe le terapie e ha scoperto che hanno funzionato in pazienti con malattia di Hodgkin. “Abbiamo cominciato a vedere risposte spettacolari” ha detto.
Eppure, anche se molti uomini e donne con recidive del linfoma Hodgkin hanno risposto ai trattamenti immunologici, ce ne erano alcuni che rimanevano profondamente resistenti. “Questi pazienti sono i più difficili da trattare” continuò O’Connor. “I loro tumori sembravano essere unici – una categoria a parte”.
Lorenzo Falchi, un compagno di studi di O’Connor e mio, era stato incuriosito da questi pazienti resistenti alle cure. Falchi è arrivato nel nostro ospedale dall’Italia, dove si è specializzato nel trattamento delle leucemie e dei linfomi; la sua particolare abilità, consolidata attraverso la sua esperienza con migliaia di pazienti, è quella della ricerca di strutture di dati ricorrenti apparentemente casuali in grosse moli di dati. Cercando nei database medici della Columbia Falchi ha fatto una scoperta sorprendente: gli uomini e le donne che hanno risposto meglio alle terapie, che aumentano la capacità di reazione del sistema immunitario, sono state sempre trattate prima con un altro farmaco chiamato azacitidina, usato raramente nei pazienti con linfoma. Una donna di 35 anni di New York con linfoma recidivo ha visto i suoi grossi noduli scomparire. Aveva ricevuto l’azacitidina come parte di un altro studio prima di passare all’immunoterapia. Un uomo, con uno stadio di tumore simile, non era stato pretrattato. Ebbe solo una risposta parziale, e la sua malattia tornò a manifestrasi subito dopo.
Falchi e O’Connor hanno deciso di utilizzare questa piccola “procedura di allenamento” per iniziare uno studio clinico in miniatura di pazienti con malattia recidiva di Hodgkin. “La proveremo solo su due o tre pazienti” mi disse Falchi. “Prima utilizzeremo l’azacitidina – intenzionalmente questa volta – e poi colpiremo il tumore con gli attivatori immunitari. Sospetto che ritroveremo le risposte che abbiamo visto nei nostri studi retrospettivi. “Anche nel tumore come cellule del polmone i medici hanno osservato che lil pretrattamento dei pazienti con azacitidina può renderli più reattivi alla terapia immunologica. Falchi e O’Connor stanno cercando di capire perché i pazienti rispondono se sono pretrattati con un farmaco che sembra, sulla base delle sue cartteristiche, non avere nulla a che fare con il sistema immunitario. Forse l’azacitidina rende le cellule tumorali più riconoscibili estranee, o forse forza le cellule immunitarie a diventare dei cacciatori più aggressivi.
Supponiamo che ogni cancro sia davvero unico, con una propria permutazione di geni e vulnerabilità – una sola “odiosa” mente. Ovviamente è assurdo immaginare che troveremo una singola medicina per trattare ciascuno di essi: ci sono 14 milioni di nuovi casi di cancro al mondo ogni anno, e diversi milioni di pazienti si presenteranno con malattie avanzate che richiedono più di un trattamento locale o chirurgico. Cercare di individualizzare il trattamento per quei casi frantumerebbe qualsiasi tetto di costo.
Ma mentre i costi medici delle terapie personalizzate vengono discussi nei forum nazionali a Washington, i pazienti nella mia modesta sala d’attesa di New York si concentrano sui loro costi personali. L’assicurazione non paga per gli usi “non-etichettati” dei medicinali: non è facile convincere un’azienda di assicurazioni che si intende utilizzare il Lipitor per curare una donna con pre-leucemia – non perché ha un alto livello di colesterolo, ma perché le cellule tumorali dipendono dal metabolismo del colesterolo per la loro crescita (in uno studio di un sottotipo di leucemia, le cellule in aumento erano fortemente dipendenti dal colesterolo, suggerendo che dosi elevate di farmaci simili a Lipitor potrebbero essere un trattamento efficace).
In casi eccezionali, i medici possono richiedere alle aziende farmaceutiche di fornire gratuitamente i farmaci – per “uso compassionevole”, per utilizzare il linguaggio del mondo farmaceutico, ma questo processo è imprevedibile e richiede tempo. In passato compilavo tali richieste una volta ogni pochi mesi. Ora mi sembra di richiedere tali eccezioni su base settimanale. Alcune sono approvate. La maggioranza, purtroppo, non viene autorizzata.
Così i medici come Falchi e O’Connor fanno quello che possono – devono usare la loro astuzia non solo contro il cancro, ma anche contro un sistema che resiste all’innovazione. Progettano e realizzano piccole sperimentazioni cliniche originali che coinvolgono solo 10 o 20 pazienti, situazioni molto lontane dalle prove centomila pazienti degli anni ’80 e ’90. Essi studiano questi pazienti con dedizione monastica, tirando fuori un’immensità di dati preziosi da quei piccoli gruppi. Di tanto in tanto, un paziente può scegliere di pagare i farmaci dalle proprie tasche – ma è raro che un paziente possa pagarsi le decine di migliaia di dollari del costo dei farmaci.
Ma non ci potrebbe essere che un numero minimo di cure che potrebbero essere utilizzate per trattare la maggioranza di questi tumori in modo efficace e meno costoso? Forse Bert Vogelstein, un genetista dei tumori all’università Johns Hopkins, è lo scienziato di qualsiasi altro, ha affrontato questo complicato problema. Vogelstein afferma che la combinazione di mutazioni genetiche in ogni singolo cancro è unica. Ma queste mutazioni genetiche possono ancora agire attraverso delle vie metaboliche o pathways
[Ndr: La via metabolica (spesso chiamata pathway metabolico o più semplicemente pathway) è l’insieme delle reazioni chimiche coinvolte in uno o più processi di anabolismo o catabolismo all’interno di una cellula] .Bersagliando queste vie metaboliche, piuttosto che i singoli geni, potremmo riorganizzare e ripensare il nostro modo di percepire e curare i tumori.
Immaginate di nuovo una cellula come una macchina complessa, con migliaia di ruote, leve e pulegge organizzate in sistemi. Questo macchina nel caso delle cellule cancerogene non funziona bene: alcune leve e pulegge sono bloccate o rovinate, e come risultato si ha che una cellulla cancerogena continua a dividersi e riprodursi senza controllo. Se ci concentriamo sulle singole parti che sono inceppate e bloccate, scopriamo che le permutazioni, ovvero il numero di combinazioni possibili interazioni tra le varie parti rotte, è apparentemente infinito: ogni istanza di una singola macchina rotta sembra avere un’impronta digitale distinta di ingranaggi rotti. Ma se invece di concentrarci sui singoli componenti che non funzionano ci concentriamo invece sui sistemi che non funzionano, allora dall’apparente altissima diversità cominciano a emergere delle strutture ricorrenti, pattern. Ad esempio supponiamo che dieci componenti funzionano in un sistema interconnesso per impedire che la macchina sbandi. Se riusciamo a identificare le parti di questo sistema, il risultato finale è che se una delle dieci parti non funziona correttamente il risultato è lo stesso: la macchina che sbanda. Supponiamo che altri 20 componenti controllino il termostato interno della macchina. Se si rompe uno di questi 20 componenti il sistema si surriscalda. Il numero di componenti – 10 o 20 – è ingannevole nella sua complessità e può avere permutazioni infinite [ndr: le possibili combinazioni di tutte le interazioni di 10 elementi differenti è pari a 3.628.000 possibili combinazioni!] Ma visto in una prospettiva di più alto livello, solo due sistemi in questa macchina sono stati coinvolti: quello della stabilità e e quello temperatura.
Il tumore, afferma Vogelstein, si comporta in maniera analoga. La maggior parte dei geni mutati nel componenti funzionano anche in cicli e circuiti: i pathways, le vie metaboliche. Superficialmente, le permutazioni dei difetti genetici potrebbero essere senza limiti, ma pensati nei pathways, la complessità può essere organizzata in un numero più limitato o in un nucleo di difetti strutturali. Forse questi pathways sono come i film di Hollywood; a prima vista, sembra che ci sia una serie infinita di possibili trame – La Corsa all’oro della California , l’Upper West Side, … . Ma l’esame più approfondito delle trame dei film produce solo una manciata di archetipi, di strutture, di narrazioni: il ragazzo incontra la ragazza, lo straniero viene in città, il figlio cerca il padre, ….
Quanti di tali pathways o sistemi operano in un sottotipo di un tumore? Guardando un tumore, quello del pancreas, e mappando le variazioni nei geni mutati attraverso centinaia di casi, il team di Vogelstein ha proposto una risposta sconcertante e semplice: 12 pathway. (Un esempio di “pathway” coinvolge i geni che consentono alle cellule di invadere altri tessuti. Questi geni consentono normalmente alle cellule di migrare attraverso parti del corpo – ma nel tumore, la migrazione diventa distorta in un’invasione pericolosa, le metastasi.) Se potessimo trovare farmaci che possano essere indirizzati a queste 12 pathways primarie, potremmo essere in grado di attaccare la maggior parte dei tumori del pancreas, nonostante la loro genetica diversità. Ma questo significa inventare 12 modi potenziali per bloccare queste pathways primarie – una sfida creativa immensa per gli scienziati, considerando che non hanno ancora capito come attacare una o due al massimo di queste dodici pathways.
Le terapie immunologiche forniscono una seconda soluzione allo stallo derivante da questa diversità illimitata. Un vantaggio nell’attivare il proprio sistema immunitario contro il tumore è che le cellule immunologiche sono generalmente agnostiche, non conoscono le mutazioni che causano una particolare crescita del tumore. Il sistema immunitario è stato progettato per individuare le differenze nelle caratteristiche superficiali di una cellula malata o straniera, identificandola e uccidendola. Si preoccupa poco di geni, è come un missile balistico intercontinentale il quale non si preoccupa degli indirizzi e-mail, o delle preferenze dietetiche, della popolazione che è stata inviata per distruggere.
Qualche anno fa, mentre scrivevo la storia dei tumori, ho intervistato Emil Freireich. Freireich, collaborava con Emil Frei presso il National Cancer Institute negli anni ’60 e ’70. Insieme si sono lanciati nelll’idea di utilizzare simultaneamente più farmaci tossici per il trattamento del tumore – quello che oggi chiamiamo chemioterapia combinata. Loro hanno inventato uno dei primi protocolli standard – vincristina, Adriamicina, metotrexato e prednisone, conosciuto come VAMP – per il trattamento delle leucemie pediatriche. Il protocollo VAMP praticamente non aveva niente del trattamento prsonalizzato (anche se le dosi potevano essere ridotte se necessario). Infatti, i medici furono scoraggiati dal tentativo di provare formule alternative.
Tuttavia come Freireich ha ricordato, molto tempo prima che arrivassero all’idea di un protocollo, c’erano piccoli e coraggiosi esperimenti; prima delle sperimentazioni cliniche c’era solo il metodo della “prova e errore”, trial & error. VAMP è stato creato attraverso la determinazione, l’istinto e un salto nel buio. Vincent T. DeVita Jr., che ha lavorato con Freireich negli anni ’60, ha scritto un libro, “La morte del cancro”, con la figlia Elizabeth DeVita-Raeburn. Nel libro ha ricordato il periodo in cui i bambini leucemici durante la sperimentazione clinica di Freireich morivano di meningite batterica durante il trattamento. Le morti minacciavano l’intera sperimentazione: se Freireich non riusciva a tenere in vita i bambini durante la terapia, non ci sarebbe possibilità di remissione. Avevano un antibiotico che avrebbe potuto uccidere il microbo, ma questo farmaco non sarebbe riuscito a penetrare la barriera sangue-cervello. Così Freireich ha deciso di provare qualcosa che andava oltre i limiti della pratica standard. Ha ordinato a DeVita, suo giovane assistente medico, di iniettare il farmaco direttamente nelle corde spinali dei suoi pazienti. Era un esempio estremo di uso non conforme del farmaco: la medicina non era destinata ad essere utilizzata nel cavo spinale. DeVita scrive:
“La prima volta che Freireich mi ha detto di farlo, ho sollevato la fiala e gli ho mostrato l’etichetta, pensando che forse non aveva letto qualcosa. Gli dissi: “Qui è scritto: Non usare intratecalmente “. Freireich mi guardò e mi puntò il suo lungo dito ossuto in faccia: “Fallo’!”, sbraitò. Lo feci, anche se ero terrorizzato. Ma ha funzionato ogni volta “.
Quando chiesi a Freireich di quell’episodio e se cambierebbe il suo comportamento nell’ attuale quadro di riferimento della terapia del cancro, lui ha sottolineato con estrema cautela. “Noi non avremmo mai ottenuto nulla nel quadro di riferimento attuale”, ha detto. Il pioniere dei protocolli per una volta rimpiangeva i tempi in cui non c’erano dei protocolli.
La medicina necessita di standard, ovviamente, altrimenti ci si potrebbe addentrare in terreni pericolosi, compromettendo la sicurezza e l’affidabilità delle cure. Ma la medicina del tumore ha anche bisogno di una sana dose di Freireich: il desiderio di leggere tra le linee (guida), di rielaborare i confini esterni, di eseguire gli esperimenti che diventano gli standard del futuro. Nel mese di Gennaio 2016, il presidente Obama ha avviato un’enorme campagna per la medicina di precisione. Il tumore è il suo bersaglio principale: utilizzando enormi moli di dati, tra cui sequenze di centinaia di migliaia di campioni e sperimentazioni eseguite nei laboratori a livello nazionale, l’obiettivo del progetto è quello di trovare farmaci personalizzati per il tumore di ogni paziente. Ma mentre si aspettano i risultati di questo progetto decennale, gli oncologi devono ancora trattare i pazienti nel presente. Per comprendere il comportamento dei singoli tumori, stiamo imparando a mescolare e adattare questi due tipi di apprendimento – lo standard e l’idiosincratico – in modi insoliti e creativi. È il tipo di medicina che volevamo imparare e per cui siamo andati nelle università di medicina, il tipo di medicina che abbiamo quasi dimenticato di praticare.
Condividi questo articolo

Questo post è la traduzione di un interessante articolo sul tema degli approcci degli oncologi alla cura dei tumori apparso sul New York Times Magazine:
The Improvisational Oncologist
di Siddhartha Mukherjee.
Mukherjee è probabilmente uno degli oncologi più famosi al mondo e uno scienziato della Columbia University. Nel 2011 ha vinto il Premio Pulitzer per la narrativa per il suo libro “L’imperatore del male. Una biografia del cancro”. Il suo nuovo libro “Il gene. Il viaggio dell’uomo al centro della vita“ è stato ancora una volta un grande successo editoriale.
Bisogna comunque tenere il contesto americano dei contenuti dell’articolo. In Italia per ragioni legislative, organizzative degli ospedali e per disponibilità di fondi alcune pratiche descritte non sono materialmente possibili. Ciò nondimeno l’articolo offre importanti spunti di riflessione.
Marzo 2016
In un’epoca di rapida proliferazione di trattamenti personalizzati, ogni caso di tumore deve essere gestito come una musica suonata ad orecchio.
La biopsia del midollo osseo era durata circa 20 minuti. Erano le 10 di una mattinata insolitamente fredda a New York di Aprile, e Donna M., una donna di 78 anni, molto padrona di sé, aveva volato da Chicago per incontrarmi nel mio studio presso il Columbia University Medical Center. La sera prima si era concessa un concerto d’orchestra, “Gli Umani”, ed ora era in attesa nella stanza in una condizione in cui a nessuno dovrebbe essere mai chiesto di aspettare: pantaloni giù, schiena curva, ginocchia sollevate al petto – una donna matura accovacciata in posizione fetale. Ho messo su i guanti sterili mentre l’infermiera ha tirato fuori un carrello contenente un ago in acciaio della lunghezza del dito indice. Il bordo dell’osso pelvico di Donna era stato anestitizzato e ho guidato l’ago, nel modo più dolce possibile, nell’estremità esterna dell’osso. Il dolore è venuto fuori dal suo corpo come una sorta di cavatappi mentre il midollo veniva aspirato, insieme ad alcuni millilitri di materiali organici rossi, ossidati di ossa, che hanno riempito la siringa. Era leggermente viscoso, a metà tra il liquido e il gel, come la polpa schiacciata di una fragola molto matura.
Seguo Donna in collaborazione alla mia collega Azra Raza da sei anni. Donna ha una sindrome pre-leucemica chiamata sindrome mielodisplastica, o MDS, che colpisce il midollo osseo e il sangue. È una malattia misteriosa con poche cure note. Il midollo osseo umano è normalmente il posto dove nascono la maggior parte delle cellule del nostro sangue – una sorta nursery per il sangue giovane. Nelle MDS, le cellule del midollo osseo acquisiscono delle mutazioni genetiche che le costringono a crescere in modo incontrollabile – ma poi queste cellule giovani non riescono né a maturare né a diventare sangue, e inoltre muoiono a frotte. È una maledizione doppia. Nella maggior parte dei tumori, il problema principale sono le cellule che rifiutano di smettere di crescere. Nel midollo Donna, questo problema è aggravato da cellule che si rifiutano di crescere.
Anche se ci sono delle comunanze tra i tumori, ovviamente, ogni tumore si comporta e si muove – “pensa“, anche – in modo diverso. Cercando di trovare un farmaco che si adattasse al tumore di Donna, Raza e io le abbiamo somministrato una gamma di farmaci. Durante tutto questo tempo Donna è stata un paziente formidabile: perennemente ingegnosa, ottimista e disposta a provare qualunque cosa. (Ogni volta che la incontro in clinica mentre con grande forza d’animo è in attesa in della sua biopsia, è il medico, non il paziente, che si sente piccolo e in posizione fetale). Ha peregrinato da una sperimentazione clinica all’altra, spostandosi di città in città, e da un farmaco all’altro, attraverso un paesaggio più desolato di quanto molti di noi possono immaginare; Donna chiama il percorso di cura la sua “monogamia seriale” con i diversi medicinali. Alcuni di questi farmaci hanno funzionato per settimane, alcuni per mesi – ma le risposte transitorie hanno lasciato la strada ad inevitabili recidive. Donna comincia ad esaurire le sue energie.
La sua biopsia quella mattina era quindi parte di routine e parte di esperimenti. Pochi minuti dopo il prelievo del midollo, un tecnico ha subito portato il materiale prelevato in laboratorio. Lì hanno estratto le cellule dalla miscela e lo hanno pipettato in piccoli pezzi come chicchi di grano, 500 celle per ogni pezzo. A ciascun pezzo, circa 1.000 in totale, si aggiungerà un piccolo dosatore di un singolo farmaco: prednisone, ad esempio, a un pezzo, procarbazina al successivo e così via. L’esperimento sperimenta circa 300 farmaci (molti non sono stati addirittura destinati ai tumori) a tre diverse dosi per valutare gli effetti dei farmaci sulle cellule Donna.
Il materiale prelevato viene immerso in un sostanza ricca di nutrienti ricchi di fattori di crescita, le cellule si raddoppieranno in un incubatore nel corso delle due settimane successive, dando luogo ad un’enorme crescita di cellule maligne – sintesi di un cancro in una capsula. Un computer, addestrato a contare e valutare le cellule, determinerà se uno dei farmaci abbia ucciso le cellule cancerose o le ha costrette a maturare in sangue quasi normale. Lungi dal fare affidamento su dati provenienti da altri trial o pazienti, l’esperimento testerà il tumore di Donna per la sua reattività rispetto ad un gruppo di farmaci. Le cellule, non i corpi, sono entrati in questo studio preclinico e i risultati guideranno il suo futuro trattamento.
Ho spiegato tutto questo a Donna. Tuttavia lei ha fatto una domanda: che cosa succederà se il farmaco che sembrava essere il più promettente si rivelerà inefficace?
“Allora proveremo il prossimo,” le dissi. “L’esperimento, speriamo, porterà più di un candidato, e andremo in fondo alla lista”.
“La medicina sarà come la chemioterapia?”
“Potrebbe, o forse no. Il farmaco che alla fine utilizzeremo potrebbe essere preso in prestito da qualche altra malattia. Potrebbe essere una pillola antinfiammatoria o un farmaco per l’asma. Per quello che ne sappiamo potrebbe essere l’aspirina”
La mia conversazione con Donna rifletteva quanto il trattamento dei tumori sia cambiato nell’ultimo decennio. Sono cresciuto come oncologo in un’epoca di protocolli standardizzati. I tumori sono stati raggruppati in categorie basati sul loro sito di origine anatomico (cancro al seno, cancro del polmone, linfoma, leucemia) e il trattamento chemioterapico, spesso una combinazione di farmaci tossici, è stato dettato da quelle classificazioni anatomiche. Le combinazioni – Adriamicina, bleomicina, vinblastina e dacarbazina, ad esempio, per il trattamento della malattia di Hodgkin – sono state raramente modificate per singoli pazienti. La prospettiva di personalizzare la terapia era disapprovata: più ci si allontana dallo standard, la teoria dice, più il paziente avrebbe finito con alta probabilità adessere curato male o gestito in modo improprio, rischiando delle recidive. Negli ospedali e nelle cliniche sono stati istituiti sistemi informatici per monitorare la conformità di un oncologo rispetto alla terapia standard. Se si è scelto di fare un’eccezione per un particolare paziente, è necessario giustificare la scelta con un’adeguata motivazione. Big Chemo ti stava guardando.
Ho memorizzato i nomi abbreviati dellle combinazioni di farmaci chemioterapici – la prima lettera di ogni farmaco – per i miei esami e li ho ripresi e utilizzati con miei pazienti durante le mie ore di clinica. C’era qualcosa di magico e sciamanico in quegli acronimi. Erano delle sorta di mantra intrisi di promesse e di pericolo: A.B.V.D. per Hodgkin’s, C.M.F. per il tumore al seno, B.E.P. per il tumore testicolo. Il gergo dei chemioterapisti era come un codice segreto o una stretta di mano; anche la sola capacità di chiamare tali veleni per nome mi faceva sentire potente. Quando i miei pazienti mi chiedevano dati statistici avevo i numeri sulle punte delle mie dita. Potevo indicare con precisone la probabilità di sopravvivenza, la probabilità di recidiva, la probabilità che la chemio li rendesse sterili o gli causasse la perdita dei capelli. Mi sentivo onniscente.
Tuttavia, mentre parlavo con Donna quella mattina, ho capito come tutta questa onniscienza abbia cominciato a diminuire – innescando un approccio più sperimentale o quasi artigianale in oncologia. La maggior parte dei pazienti affetti da tumore è ancora trattata con quei protocolli standardizzati, governati dall’anatomia dell’organo del cancro. Ma per i pazienti come Donna, per i quali i soliti trattamenti non funzionano, gli oncologi devono utilizzare la loro conoscenza, spirito e creatività per inventare terapie individualizzate. Sempre più ci avviciniamo ad ogni paziente come un problema unico da risolvere. Farmaci tossici che agiscono in modo indiscriminato su tutte le cellule stanno lasciando il posto a molecole più agili che possono mirare un modo più preciso all’attivazione o disattivazione di pathways complessi nelle cellule, rimuovendo i fattori di crescita, accelerarando o decelerarando la risposta immunitaria o soffocando la fornitura di nutrienti e ossigeno alle cellule tumorali. Sempre più dobbiamo trovare modi per usare i farmaci come strumenti di precisione per inceppare e spegnere interruttori selettivi in particolari cellule tumorali. Gli oncologi formati per seguire le regole sono ora invitati a rinventarle.
Il pensiero che ogni singolo tumore potrebbe richiedere un trattamento specifico individualizzato può essere profondamente inquietante. Michael Lerner, uno scrittore che ha lavorato con i pazienti affetti da tumore, una volta ha paragonato l’esperienza di una diagnosi di tumore essere a quella di un lancio da un paracadute senza una mappa o una bussola; ora è l’oncologo che si sente paracadutato su uno strano paesaggio, senza alcuna idea di quale sia la strada da percorrere. Spesso non esistono dati statistici di esperienze precedenti, e ancor meno certezze. L’asticella del successo è diventata più alta, i successi più sorprendenti e i fallimenti più personali. In precedenza si stendevano veli di colpa intorno a un paziente. Quando non rispondeva alla chemioterapia, colpa era sua: lei aveva fallito. Ora, se non riesco a trovare uno strumento nel crescente insieme di farmaci a disposizione per colpire le vulnerabilità del cancro, allora la sensazione è che il trend si è invertito: è il medico che ha fallito.
Eppure, l’attuale epoca senza mappe precise di navigazione del tumore può avere un più grande potenziale per i pazienti rispetto a tutte le situazioni precedenti – anche se siamo nella situazione in cui il mondo che conosciamo si sposta sotto i nostri piedi. Non dobbiamo più trattare il cancro solo con la risposta spuntata dei protocolli standard, in cui la malattia è immaginata come un avversario uniforme, senza un volto. Invece dovremmo cercare di valutare la particolare personalità e il temperamento di una malattia individuale, in modo da poter adattare una risposta con estrema precisione. È la mente detestabile di ogni tumore che stiamo cercando disperatamente di comprendere.
Il tumore e le sue cure un tempo ci sembravano più semplici. Nel dicembre del 1969, un gruppo di sostenitori delle cure del cancro guidato dalla filantropa Mary Lasker ha pubblicizzato con grande enfasi la richiesta di una guerra nazionale contro il cancro in un annuncio a pagina intera sul The New York Times: “Mr. Nixon: tu puoi curare il cancro “. Ciò ha simboleggiato l’idea di una sola soluzione ad una singola malattia monumentale. Per un po’ l’idea portante di questa approccio è stata considerata la sequenza: intervento chirurgico, radiazioni e chemioterapia; una strategia colloquialmente nota come “taglia e brucia”. Utilizzando combinazioni di farmaci chemioterapici uomini e donne sono stati trascinati fino all’orlo della tollerabilità fisiologica, ma poi riacciuffati giusto in tempo in tempo per spedire il tumore, e non il suo ospite, fuori careggiata.
Durante gli anni ’80 e ’90 decine di migliaia di pazienti hanno partecipato a sperimentazioni cliniche che hanno messo a confronto i risultati di pazienti a cui era stata somministrata la combinazione standard di chemioterapia con quelli di altri pazienti a cui erano state somministrate combinazioni leggermente differenti degli stessi farmaci. Alcuni hanno risposto bene, ma per molti altri, le recidive sono state una routine – e i miglioramenti per la maggior parte dei tumori sono stati piccoli e incrementali. Sono stati fatti pochi sforzi per differenziare i pazienti; invece, quando le cure promesse per le malattie più avanzate non sono arrivate, si è pensato di aumentare le dosi dei farmaci a disposizione. Nella commedia Wit di Margaret Edson, una professoressa di inglese che aveva un tumore ovarico, il linguaggio incomprensibile di questi studi è stato rinterpretato inventando nomi assurdi per i farmaci chemioterapici che le erano stati pompati nel suo corpo: “Sono sopravvissuta a otto trattamenti di esametofosfacil e vinlatino alla dose massima, signore e signori. Ho stabilito un nuovo record “.
Ad essere sinceri, abbiamo imparato lezioni importanti dagli studi clinici. Utilizzando combinazioni di farmaci chemioterapici abbiamo imparato a trattare tumori particolari: linfomi aggressivi e alcune varianti di tumori al seno, testicolo e colon. Ma per la maggior parte degli uomini e delle donne con un tumore, i risultati clinici sono stati delle grandi delusioni. Nessun record è stato infranto o abbattuto – ma i pazienti lo erano.
Una svolta è avvenuta negli anni 2000, poco dopo il progetto del genoma umano, quando gli scienziati hanno imparato a sequenziare i genomi delle cellule tumorali. Il tumore è una malattia tipicamente genetica. I geni mutanti nelle cellule tumorali alterano la normale fisiologia della crescita e, infine, ne determinano una proliferazione maligna. Questa caratteristica si trova al centro di tutte le forme tumorali: a differenza delle normali cellule, le cellule tumorali hanno dimenticato come smettere di dividersi (o talvolta, hanno dimenticato come morire). Ma se anche potessimo sequenziare decine di migliaia di geni nei singoli campioni dei tumori, quello che emerge è l’unicità di ogni singolo tumore. Supponiamo che due tumori al seno dall’aspetto simile si manifestino nello stesso momento in due gemelle identiche; le mutazioni dei due tumori saranno le stesse stesse? È improbabile: sequenziando le mutazioni nel tumore al seno di una gemella, potremmo trovare, diciamo, 74 geni mutati (di circa 22.000 geni totali nell’uomo). Nell’altra gemella potremmo trovare 42 mutazioni e se guardassimo una terza donna non correlata alle die gemelle con il tumore al seno, potremmo trovarne 18. Tra i tre casi, ci potrebbero esserci solo cinque geni che si sovrappongono. Il resto sono mutazioni particolari per il tumore di ogni donna.
Nessuna altra malattia umana conosciuta possiede questo grado di eterogeneità genetica. Il diabete in età adulta, ad esempio, è una malattia genetica complessa, ma sembra essere dominata da variazioni di una sola dozzina di geni. Il tumore invece ha variazioni potenzialmente illimitate. Come i volti, come le impronte digitali – come noi stessi – ogni tumore è caratterizzato dai suoi segni distintivi: un insieme di singole cicatrici stampate su un genoma individuale. La malattia iconica del XX secolo sembra riflettere l’ossessione della nostra cultura per l’individualità.
Se ogni singolo tumore ha una singola combinazione di mutazioni dei geni forse questa variabilità spiega le divergenze straordinarie nelle risposte al trattamento. Il sequenziamento ci permette di identificare i cambiamenti genetici che sono peculiari per un dato tumore. Potremmo utilizzare queste informazioni per guidare la cura del tumore – titolare il trattamento giusto per il tumore del singolo paziente.
Molti degli importanti successi nella cura dei tumori degli ultimi decenni sono esempi di farmaci che sono stati abbinati alle particolari vulnerabilità di singoli tumori. Il farmaco Gleevec, per esempio, può uccidere le cellule di leucemia – ma solo se le cellule tumorali del paziente portano la mutazione del gene chiamata BCR-ABL. Tarceva, una terapia specifica del tumore ai polmoni, funziona in maniera efficace se le cellule tumorali del paziente hanno una particolare mutazione genetica; per i pazienti affetti sempre affetti dal tumore del polmone privi di tale mutazione assumere tale farmaco è equivalente ad un placebo. Poiché questi medicinali mirano a mutazioni o comportamenti specifici per le cellule tumorali (ma non le cellule normali), molti di questi farmaci hanno tossicità sorprendentemente minime – molto più basse rispetto alle combinazioni chemioterapiche del passato.
Qualche giorno dopo la visita di Donna alla clinica, sono andato alla mia riunione settimanale con Raza al nono piano dell’ospedale. La paziente quella mattina era K.C., una donna di 79 anni con un tumore al al sangue. Raza stava seguendo la sua malattia – mantenendola in vita – da un decennio.
“Il suo tumore sta evolvendo in una leucemia acuta” disse Raza. Anche questo è un comportamento distintivo di alcuni tumori che oggi possiamo verificare usando biopsie, scansioni CT e nuove tecniche potenti come il sequenziamento dei geni: possiamo vedere i tumori che modificano mutazioni non pericolose in tipologie più aggressive davanti ai nostri occhi.
“Il tumore è stato sequenziato ?” chiesi.
“Sì, abbiamo la sequenza”, disse Raza, mentre ci accostavamo verso uno schermo per esaminarlo. Dall’elenco dei geni mutati lesse: “P53, DNMT3a e Tet2”. “E una delezione nel Cromosoma 5.” Nel caso del tumore di K.C. un intero segmento del genoma era stato eliminato e scomparso – una delle mutazioni più pericolose che un tumore possa generare.
“Cosa ne pensi dell’ATRA?” chiesi. Avevamo trattato alcuni pazienti che portavano alcune delle mutazioni di K.C. con questo farmaco e avevamo notato alcune importanti risposte .
“No. Preferirei piuttosto provare il Revlimid, ma con una dose più elevata. Lei ha già risposto bene in passato a questo farmaco e le mutazioni rimangono le stesse. Ho la sensazione che possa funzionare”
Mentre Raza e io ritornavamo nella stanza di C.C. per informarla del piano, non potevo fare a meno di pensare alle conclusioni a cui eravamo arrivati: piccole evidenze, osservazioni, istinto. Una medicina basata su premonizioni. Chemioterapia da sensazioni. La discussione sarebbe potuta sembrare molto particolare o artefatta ad un estraneo, ma non c’era nulla di supponente. Abbiamo analizzato queste possibilità con la massima serietà. Abbiamo studiato le sequenze, considerato le risposte passate, la recente storia del paziente – e poi le abbiamo portate avanti sulla base delle nostre migliori ipotesi. Le nostre decisioni sono motivate dalla scienza, sì, ma anche da un certo senso per l’arte della medicina.
Gli oncologi praticano questa arte anche in settori che fanno meno affidamento sui geni e mutazioni. Una settimana dopo la biopsia di Donna, sono andato a trovare Owen O’Connor, un oncologo che dirige il centro dei linfomi della Columbia. O’Connor, un oncologo sulla cinquantina, mi ricorda un veicolo anfibio a terra, in grado di navigare su ogni terreno. Ci siamo seduti nel suo ufficio, con ampie vetrate luminose con vista sulla Rockefeller Plaza. Per decenni, mi ha spiegato, gli oncologi hanno trattato il linfoma di Hodgkin con procedure standard. “C’erano opzioni limitate”, ha detto O’Connor. “Abbiamo dato alcuni pazienti più chemioterapia, in alcuni casi con con dosi più elevate e farmaci più tossici, sperando in una risposta. Per alcuni abbiamo cercato di curare la malattia usando il trapianto di midollo osseo. “Ma il tasso di fallimento era elevato: circa il 30 per cento dei pazienti non ha risposto e la metà di loro è morta.
Poi un anno fa ha provato qualcosa di nuovo. Ha cominciato ad usare la terapia immunologica per il trattamento dei casi di recidiva, il linfoma Hodgkin refrattario. Le terapie immunologiche sono disponibili in varie forme. Ci sono gli anticorpi: proteine simili a missili, derivate dai nostri sistemi immunitari, che sono progettati per attaccare e distruggere i microbi stranieri (gli anticorpi possono anche essere prodotti artificialmente attraverso l’ingegneria genetica, muniti con tossine e utilizzati come “farmaci” per uccidere le cellule tumorali) . E ci sono farmaci che inducono il sistema immunitario del paziente a riconoscere e uccidere le cellule tumorali, un modalità di cura ripresa dopo decenni di scarsa considerazione. O’Connor ha usato entrambe le terapie e ha scoperto che hanno funzionato in pazienti con malattia di Hodgkin. “Abbiamo cominciato a vedere risposte spettacolari” ha detto.
Eppure, anche se molti uomini e donne con recidive del linfoma Hodgkin hanno risposto ai trattamenti immunologici, ce ne erano alcuni che rimanevano profondamente resistenti. “Questi pazienti sono i più difficili da trattare” continuò O’Connor. “I loro tumori sembravano essere unici – una categoria a parte”.
Lorenzo Falchi, un compagno di studi di O’Connor e mio, era stato incuriosito da questi pazienti resistenti alle cure. Falchi è arrivato nel nostro ospedale dall’Italia, dove si è specializzato nel trattamento delle leucemie e dei linfomi; la sua particolare abilità, consolidata attraverso la sua esperienza con migliaia di pazienti, è quella della ricerca di strutture di dati ricorrenti apparentemente casuali in grosse moli di dati. Cercando nei database medici della Columbia Falchi ha fatto una scoperta sorprendente: gli uomini e le donne che hanno risposto meglio alle terapie, che aumentano la capacità di reazione del sistema immunitario, sono state sempre trattate prima con un altro farmaco chiamato azacitidina, usato raramente nei pazienti con linfoma. Una donna di 35 anni di New York con linfoma recidivo ha visto i suoi grossi noduli scomparire. Aveva ricevuto l’azacitidina come parte di un altro studio prima di passare all’immunoterapia. Un uomo, con uno stadio di tumore simile, non era stato pretrattato. Ebbe solo una risposta parziale, e la sua malattia tornò a manifestrasi subito dopo.
Falchi e O’Connor hanno deciso di utilizzare questa piccola “procedura di allenamento” per iniziare uno studio clinico in miniatura di pazienti con malattia recidiva di Hodgkin. “La proveremo solo su due o tre pazienti” mi disse Falchi. “Prima utilizzeremo l’azacitidina – intenzionalmente questa volta – e poi colpiremo il tumore con gli attivatori immunitari. Sospetto che ritroveremo le risposte che abbiamo visto nei nostri studi retrospettivi. “Anche nel tumore come cellule del polmone i medici hanno osservato che lil pretrattamento dei pazienti con azacitidina può renderli più reattivi alla terapia immunologica. Falchi e O’Connor stanno cercando di capire perché i pazienti rispondono se sono pretrattati con un farmaco che sembra, sulla base delle sue cartteristiche, non avere nulla a che fare con il sistema immunitario. Forse l’azacitidina rende le cellule tumorali più riconoscibili estranee, o forse forza le cellule immunitarie a diventare dei cacciatori più aggressivi.
Supponiamo che ogni cancro sia davvero unico, con una propria permutazione di geni e vulnerabilità – una sola “odiosa” mente. Ovviamente è assurdo immaginare che troveremo una singola medicina per trattare ciascuno di essi: ci sono 14 milioni di nuovi casi di cancro al mondo ogni anno, e diversi milioni di pazienti si presenteranno con malattie avanzate che richiedono più di un trattamento locale o chirurgico. Cercare di individualizzare il trattamento per quei casi frantumerebbe qualsiasi tetto di costo.
Ma mentre i costi medici delle terapie personalizzate vengono discussi nei forum nazionali a Washington, i pazienti nella mia modesta sala d’attesa di New York si concentrano sui loro costi personali. L’assicurazione non paga per gli usi “non-etichettati” dei medicinali: non è facile convincere un’azienda di assicurazioni che si intende utilizzare il Lipitor per curare una donna con pre-leucemia – non perché ha un alto livello di colesterolo, ma perché le cellule tumorali dipendono dal metabolismo del colesterolo per la loro crescita (in uno studio di un sottotipo di leucemia, le cellule in aumento erano fortemente dipendenti dal colesterolo, suggerendo che dosi elevate di farmaci simili a Lipitor potrebbero essere un trattamento efficace).
In casi eccezionali, i medici possono richiedere alle aziende farmaceutiche di fornire gratuitamente i farmaci – per “uso compassionevole”, per utilizzare il linguaggio del mondo farmaceutico, ma questo processo è imprevedibile e richiede tempo. In passato compilavo tali richieste una volta ogni pochi mesi. Ora mi sembra di richiedere tali eccezioni su base settimanale. Alcune sono approvate. La maggioranza, purtroppo, non viene autorizzata.
Così i medici come Falchi e O’Connor fanno quello che possono – devono usare la loro astuzia non solo contro il cancro, ma anche contro un sistema che resiste all’innovazione. Progettano e realizzano piccole sperimentazioni cliniche originali che coinvolgono solo 10 o 20 pazienti, situazioni molto lontane dalle prove centomila pazienti degli anni ’80 e ’90. Essi studiano questi pazienti con dedizione monastica, tirando fuori un’immensità di dati preziosi da quei piccoli gruppi. Di tanto in tanto, un paziente può scegliere di pagare i farmaci dalle proprie tasche – ma è raro che un paziente possa pagarsi le decine di migliaia di dollari del costo dei farmaci.
Ma non ci potrebbe essere che un numero minimo di cure che potrebbero essere utilizzate per trattare la maggioranza di questi tumori in modo efficace e meno costoso? Forse Bert Vogelstein, un genetista dei tumori all’università Johns Hopkins, è lo scienziato di qualsiasi altro, ha affrontato questo complicato problema. Vogelstein afferma che la combinazione di mutazioni genetiche in ogni singolo cancro è unica. Ma queste mutazioni genetiche possono ancora agire attraverso delle vie metaboliche o pathways
[Ndr: La via metabolica (spesso chiamata pathway metabolico o più semplicemente pathway) è l’insieme delle reazioni chimiche coinvolte in uno o più processi di anabolismo o catabolismo all’interno di una cellula] .Bersagliando queste vie metaboliche, piuttosto che i singoli geni, potremmo riorganizzare e ripensare il nostro modo di percepire e curare i tumori.
Immaginate di nuovo una cellula come una macchina complessa, con migliaia di ruote, leve e pulegge organizzate in sistemi. Questo macchina nel caso delle cellule cancerogene non funziona bene: alcune leve e pulegge sono bloccate o rovinate, e come risultato si ha che una cellulla cancerogena continua a dividersi e riprodursi senza controllo. Se ci concentriamo sulle singole parti che sono inceppate e bloccate, scopriamo che le permutazioni, ovvero il numero di combinazioni possibili interazioni tra le varie parti rotte, è apparentemente infinito: ogni istanza di una singola macchina rotta sembra avere un’impronta digitale distinta di ingranaggi rotti. Ma se invece di concentrarci sui singoli componenti che non funzionano ci concentriamo invece sui sistemi che non funzionano, allora dall’apparente altissima diversità cominciano a emergere delle strutture ricorrenti, pattern. Ad esempio supponiamo che dieci componenti funzionano in un sistema interconnesso per impedire che la macchina sbandi. Se riusciamo a identificare le parti di questo sistema, il risultato finale è che se una delle dieci parti non funziona correttamente il risultato è lo stesso: la macchina che sbanda. Supponiamo che altri 20 componenti controllino il termostato interno della macchina. Se si rompe uno di questi 20 componenti il sistema si surriscalda. Il numero di componenti – 10 o 20 – è ingannevole nella sua complessità e può avere permutazioni infinite [ndr: le possibili combinazioni di tutte le interazioni di 10 elementi differenti è pari a 3.628.000 possibili combinazioni!] Ma visto in una prospettiva di più alto livello, solo due sistemi in questa macchina sono stati coinvolti: quello della stabilità e e quello temperatura.
Il tumore, afferma Vogelstein, si comporta in maniera analoga. La maggior parte dei geni mutati nel componenti funzionano anche in cicli e circuiti: i pathways, le vie metaboliche. Superficialmente, le permutazioni dei difetti genetici potrebbero essere senza limiti, ma pensati nei pathways, la complessità può essere organizzata in un numero più limitato o in un nucleo di difetti strutturali. Forse questi pathways sono come i film di Hollywood; a prima vista, sembra che ci sia una serie infinita di possibili trame – La Corsa all’oro della California , l’Upper West Side, … . Ma l’esame più approfondito delle trame dei film produce solo una manciata di archetipi, di strutture, di narrazioni: il ragazzo incontra la ragazza, lo straniero viene in città, il figlio cerca il padre, ….
Quanti di tali pathways o sistemi operano in un sottotipo di un tumore? Guardando un tumore, quello del pancreas, e mappando le variazioni nei geni mutati attraverso centinaia di casi, il team di Vogelstein ha proposto una risposta sconcertante e semplice: 12 pathway. (Un esempio di “pathway” coinvolge i geni che consentono alle cellule di invadere altri tessuti. Questi geni consentono normalmente alle cellule di migrare attraverso parti del corpo – ma nel tumore, la migrazione diventa distorta in un’invasione pericolosa, le metastasi.) Se potessimo trovare farmaci che possano essere indirizzati a queste 12 pathways primarie, potremmo essere in grado di attaccare la maggior parte dei tumori del pancreas, nonostante la loro genetica diversità. Ma questo significa inventare 12 modi potenziali per bloccare queste pathways primarie – una sfida creativa immensa per gli scienziati, considerando che non hanno ancora capito come attacare una o due al massimo di queste dodici pathways.
Le terapie immunologiche forniscono una seconda soluzione allo stallo derivante da questa diversità illimitata. Un vantaggio nell’attivare il proprio sistema immunitario contro il tumore è che le cellule immunologiche sono generalmente agnostiche, non conoscono le mutazioni che causano una particolare crescita del tumore. Il sistema immunitario è stato progettato per individuare le differenze nelle caratteristiche superficiali di una cellula malata o straniera, identificandola e uccidendola. Si preoccupa poco di geni, è come un missile balistico intercontinentale il quale non si preoccupa degli indirizzi e-mail, o delle preferenze dietetiche, della popolazione che è stata inviata per distruggere.
Qualche anno fa, mentre scrivevo la storia dei tumori, ho intervistato Emil Freireich. Freireich, collaborava con Emil Frei presso il National Cancer Institute negli anni ’60 e ’70. Insieme si sono lanciati nelll’idea di utilizzare simultaneamente più farmaci tossici per il trattamento del tumore – quello che oggi chiamiamo chemioterapia combinata. Loro hanno inventato uno dei primi protocolli standard – vincristina, Adriamicina, metotrexato e prednisone, conosciuto come VAMP – per il trattamento delle leucemie pediatriche. Il protocollo VAMP praticamente non aveva niente del trattamento prsonalizzato (anche se le dosi potevano essere ridotte se necessario). Infatti, i medici furono scoraggiati dal tentativo di provare formule alternative.
Tuttavia come Freireich ha ricordato, molto tempo prima che arrivassero all’idea di un protocollo, c’erano piccoli e coraggiosi esperimenti; prima delle sperimentazioni cliniche c’era solo il metodo della “prova e errore”, trial & error. VAMP è stato creato attraverso la determinazione, l’istinto e un salto nel buio. Vincent T. DeVita Jr., che ha lavorato con Freireich negli anni ’60, ha scritto un libro, “La morte del cancro”, con la figlia Elizabeth DeVita-Raeburn. Nel libro ha ricordato il periodo in cui i bambini leucemici durante la sperimentazione clinica di Freireich morivano di meningite batterica durante il trattamento. Le morti minacciavano l’intera sperimentazione: se Freireich non riusciva a tenere in vita i bambini durante la terapia, non ci sarebbe possibilità di remissione. Avevano un antibiotico che avrebbe potuto uccidere il microbo, ma questo farmaco non sarebbe riuscito a penetrare la barriera sangue-cervello. Così Freireich ha deciso di provare qualcosa che andava oltre i limiti della pratica standard. Ha ordinato a DeVita, suo giovane assistente medico, di iniettare il farmaco direttamente nelle corde spinali dei suoi pazienti. Era un esempio estremo di uso non conforme del farmaco: la medicina non era destinata ad essere utilizzata nel cavo spinale. DeVita scrive:
“La prima volta che Freireich mi ha detto di farlo, ho sollevato la fiala e gli ho mostrato l’etichetta, pensando che forse non aveva letto qualcosa. Gli dissi: “Qui è scritto: Non usare intratecalmente “. Freireich mi guardò e mi puntò il suo lungo dito ossuto in faccia: “Fallo’!”, sbraitò. Lo feci, anche se ero terrorizzato. Ma ha funzionato ogni volta “.
Quando chiesi a Freireich di quell’episodio e se cambierebbe il suo comportamento nell’ attuale quadro di riferimento della terapia del cancro, lui ha sottolineato con estrema cautela. “Noi non avremmo mai ottenuto nulla nel quadro di riferimento attuale”, ha detto. Il pioniere dei protocolli per una volta rimpiangeva i tempi in cui non c’erano dei protocolli.
La medicina necessita di standard, ovviamente, altrimenti ci si potrebbe addentrare in terreni pericolosi, compromettendo la sicurezza e l’affidabilità delle cure. Ma la medicina del tumore ha anche bisogno di una sana dose di Freireich: il desiderio di leggere tra le linee (guida), di rielaborare i confini esterni, di eseguire gli esperimenti che diventano gli standard del futuro. Nel mese di Gennaio 2016, il presidente Obama ha avviato un’enorme campagna per la medicina di precisione. Il tumore è il suo bersaglio principale: utilizzando enormi moli di dati, tra cui sequenze di centinaia di migliaia di campioni e sperimentazioni eseguite nei laboratori a livello nazionale, l’obiettivo del progetto è quello di trovare farmaci personalizzati per il tumore di ogni paziente. Ma mentre si aspettano i risultati di questo progetto decennale, gli oncologi devono ancora trattare i pazienti nel presente. Per comprendere il comportamento dei singoli tumori, stiamo imparando a mescolare e adattare questi due tipi di apprendimento – lo standard e l’idiosincratico – in modi insoliti e creativi. È il tipo di medicina che volevamo imparare e per cui siamo andati nelle università di medicina, il tipo di medicina che abbiamo quasi dimenticato di praticare.